Câu 9: Cho 16,2 gam kim loại M, hóa trị n tác dụng với 0,15 mol O2. Chất rắn thu được sau phản ứng cho hòa tan hoàn toàn vào dung dịch HCl dư thấy bay ra 13,44 lít H2 ở đktc. Kim loại M là?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án C
Các phương trình phản ứng :
M tác dụng với O2: 4 M + 2 n O 2 → t 0 2 M n O n
Chất rắn sau phản ứng tác dụng với dung dịch HCl thu được khí H2, chứng tỏ chất rắn sau có M dư nên O2 hết - chất rắn sau gồm M dư và M2On :
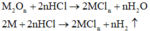
Tính toán:
Số mol H2 thu được là: n H 2 = 13 , 44 22 , 4 = 0 , 6 m o l
Sơ đồ phản ứng:
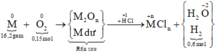
Các quá trình nhường, nhận electron cho cả quá trình:
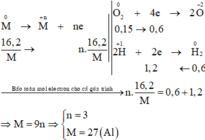

Đáp án B.
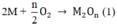
Chất rắn sau phản ứng hòa tan trong HCl thấy có khí thoát ra chứng ở có M dư
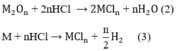
Số mol H2: 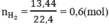
Theo phương trình (1)
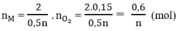
Theo phương trình (3)
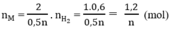
Tổng số mol M là 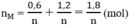
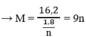
⇒ Giá trị thỏa mãn là n = 3, M = 27 M : Al

Chất rắn sau phản ứng hòa tan trong HCl thấy có khí thoát ra chứng ở có M dư
Số mol H2:
Theo phương trình (1)
Theo phương trình (3)
Tổng số mol M là
⇒ Giá trị thỏa mãn là n = 3, M = 27 M : Al

Ta có: \(n_{SO_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
\(n_S=\dfrac{4,8}{32}=0,15\left(mol\right)\)
Coi hh chất rắn gồm M và O.
⇒ nO = 0,15.2 = 0,3 (mol)
Ta có: \(n_M=\dfrac{16,2}{M_M}\left(mol\right)\)
BT e, có: n.nM = 2nO + 2nSO2 + 6nS
\(\Rightarrow\dfrac{16,2n}{M_M}=1,8\Rightarrow M_M=9n\left(g/mol\right)\)
Với n = 3 thì MM = 27 (g/mol) là thỏa mãn.
Vậy: M là Al.

Cho 16,2 gam kim loại M có hóa trị n tác dụng với 0,15 mol O2. Chất rắn thu được sau phản ứng đem hòa tan vào dung dịch HCl dư thấy thoát ra 13,44 lít H2 (đktc). Kim loại M là
A. Fe
B. Al
C. Ca
D. Mg

\(2R+2nHCl\rightarrow2RCl_n+nH_2\)
.0,12/n...............0,12/n......0,06......
\(R_2O_n+2nHCl\rightarrow2RCl_n+nH_2O\)
.0,3/n......................................0,3....
\(n_{H_2O}=2n_{O_2}=0,3\left(mol\right)\)
Có : \(m=13,44=m_R+m_{R_2O_n}=\dfrac{0,12R}{n}+\dfrac{\left(2R+16n\right)0,3}{n}\)
\(\Rightarrow R=12n\)
=> R là Mg
\(n_{Al\left(I\right)}=\dfrac{3}{2}n_{H_2}=0,045\left(mol\right)\)
\(n_{Al\left(II\right)}=2n_{Al_2O_3}=\dfrac{2}{3}n_{H_2O}=\dfrac{2}{3}.2n_{O_2}=\dfrac{4}{3}n_{O_2}=\dfrac{1}{15}\left(mol\right)\)
\(\Rightarrow m_{Al}=m=3,015\left(g\right)\)
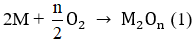
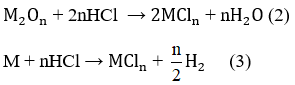
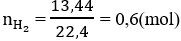
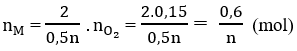
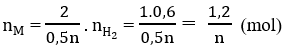
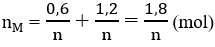
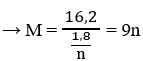




\(n_{H_2}=\dfrac{13.44}{22.4}=0.6\left(mol\right)\)
\(n_{M\left(pu\right)}=a\left(mol\right)\)
Bảo toàn e :
\(na=0.15\cdot4+0.6\cdot2=1.8\)
\(a=\dfrac{1.8}{n}\)
\(M=\dfrac{16.2}{\dfrac{1.8}{n}}=9n\)
\(n=3\Rightarrow M=27.M:Al\)
Bảo toàn e toàn bộ quá trình ta có: $n_{M}=\frac{1,8}{n}(mol)$
$\Rightarrow M_{M}=9n$
Lập bảng biện luận suy ra M là Al