Cho hỗn hợp gồm Na và Fe phản ứng hết với dung dịch HCl dư, thu được V lít khí H2. Nếu cho kim loại M (hóa trị II không đổi) có khối lượng bằng một nữa tổng khối lượng Na và Fe tác dụng hết với dung dịch HCl dư cũng thu được V lít khí H2Viết các phương trình phản ứng xảy ra và xác định kim loại M. Biết các khi đo ở cùng điều kiện về nhiệt độ và áp suất
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

I. Nội qui tham gia "Giúp tôi giải toán"
1. Không đưa câu hỏi linh tinh lên diễn đàn, chỉ đưa các bài mà mình không giải được hoặc các câu hỏi hay lên diễn đàn;
2. Không trả lời linh tinh, không phù hợp với nội dung câu hỏi trên diễn đàn.
3. Không "Đúng" vào các câu trả lời linh tinh nhằm gian lận điểm hỏi đáp.
Các bạn vi phạm 3 điều trên sẽ bị giáo viên của Online Math trừ hết điểm hỏi đáp, có thể bị khóa tài khoản hoặc bị cấm vĩnh viễn không đăng nhập vào trang web.

Đáp án A
Theo định luật bảo toàn mol electron, ta có:
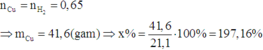
Với bài này, đề bài hỏi khối lượng chất rắn bằng bao nhiêu phần trăm so với khối lượng đầu.

2Na + H2SO4 -> Na2SO4+ H2
a -> 0,5a
Fe+ H2SO4->FeSO4 + H2
b-> b
2Al+ 3H2SO4 ->Al2(SO4)3 + 3H2
Sau khi thay :
M + H2SO4-> MSO4+ H2
c-> c
=> c =0,5a+b
m M = 1/2 .(m Na+ m Fe ) = 1/2 . (23a +56b) = M. (0,5a +b )
-> 23a+56b=M.(a+2b)
=> b.(56-2M) = a .(M-23)
do a,b >0
=> biểu thức có nghiệm <=> 56-2M > 0 và M-23 >0
<=> 28>M>23
=> M : Mg

Đáp án B
n H 2 = 0 , 1 ; n NO = 0 , 4 . Gọi n là hóa trị của M.
Căn cứ vào 4 đáp án ta có 2 trường hợp:
+) M là kim loại đứng trước H trong dãy hoạt động hóa học. Khi đó cả M và Fe có phản ứng với dung dịch HCl. Vì hóa trị của M không đổi nên sự chênh lệch về số electron trao đổi trong hai lần thí nghiệm là do sắt có hai mức hóa trị là II và III.
Áp dụng định luật bảo toàn mol electron:
- Khi hòa tan hỗn hợp vào dung dịch HCl, ta có: 2 n Fe + n . n M = 2 n H 2
- Khi hòa tan hỗn hợp vào dung dịch HNO3, ta có: 3 n Fe + n . n M = 3 n NO
Trừ hai vế của hai phương trình cho nhau, ta được:
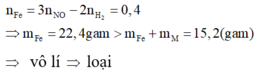
+) M là kim loại đứng sau H và trước Pt trong dãy hoạt động hóa học. Khi đó M không phản ứng được với dung dịch HCl và phản ứng được với dung dịch HNO3. Áp dụng định luật bảo toàn mol electron:
- Khi hòa tan hỗn hợp vào dung dịch HCl, ta có:







Đặt \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{Na}=b\left(mol\right)\end{matrix}\right.\)
PTHH:
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
a--------------------------->a
\(2Na+2HCl\rightarrow2NaCl+H_2\)
b---------------------------->0,5b
Ta có: \(m_M=\dfrac{1}{2}.\left(m_{Fe}+m_{Na}\right)=\dfrac{1}{2}.\left(56a+23b\right)=28a+11,5b\left(g\right)\)
PTHH: \(M+2HCl\rightarrow MCl_2+H_2\)
(a+0,5b)<----------------(a+0,5b)
\(\Rightarrow M_M=\dfrac{28a+11,5b}{a+0,5b}\\ \Rightarrow\dfrac{28a}{a}>M_M>\dfrac{11,5a}{0,5a}\\ \Leftrightarrow28>M_M>23\)
Vậy M là Magie (Mg)