Cho 4,4 g hỗn hợp 2 kim loại kiềm thổ nằm ở hai chu kỳ kế tiếp nhau tác dụng với dung dịch HCl dư thấy thoát ra 3,7285 lít khí h2 ở điều kiện chuẩn a) xác định tên hai kim loại kiềm thổ b) tính khối lượng của mỗi kim loại trong hỗn hợp ban đầu
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a) Sửa đề: `3,7285 -> 3,7185` và `2,075 -> 20,75`
\(n_{H_2}=\dfrac{3,7185}{24,79}=0,15\left(mol\right)\)
Đặt CT chung của 2 kim loại kiềm là R
\(2R+2H_2O\rightarrow2ROH+H_2\)
0,3<-------------0,3<-----0,15
\(ROH+HCl\rightarrow RCl+H_2O\)
0,3------------->0,3
\(\Rightarrow M_{RCl}=\dfrac{20,75}{0,3}=\dfrac{415}{6}\left(g/mol\right)\\ \Rightarrow M_R=\dfrac{415}{6}-35,5=\dfrac{101}{3}\left(g/mol\right)\)
`=>` 2 kim loại là Na và K
b) Đặt \(\left\{{}\begin{matrix}n_{Na}=a\left(mol\right)\\n_K=b\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}a+b=0,3\\58,5+74,5=20,75\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,2\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Na}=0,1.23=2,3\left(g\right)\\m_K=0,2.39=7,8\left(g\right)\end{matrix}\right.\)

a. Gọi công thức chung của 2 kim loại kiềm ở 2 chu kỳ kế tiếp là R
\(2R+2HCl\rightarrow2RCl+H_2\\ n_R=2n_{H_2}=0,2\left(mol\right)\\ \Rightarrow M_R=\dfrac{6,2}{0,2}=31\\ \Rightarrow2KLlà:Na,K\\ b.n_{HCl}=2n_{H_2}=0,2\left(mol\right)\\ HCldư20\%\Rightarrow CM_{HCl}=\dfrac{0,2.120\%}{0,4}=0,6M\)

a, Đặt kim loại trung bình là R \(\rightarrow \) R hóa trị II
\(PTHH:R+2HCl\to RCl_2+H_2\\ \Rightarrow n_R=n_{H_2}=\dfrac{4,48}{22,4}=0,2(mol)\\ \Rightarrow M_R=\dfrac{6,5}{0,2}=32,5(g/mol)\)
Vậy 2 KL đó là Mg (24) và Ca (40)
\(b,\) Đặt \((n_{Mg};n_{Ca})=(x;y)(mol)\)
\(\Rightarrow \begin{cases} 24x+40y=6,5\\ x+y=n_{H_2}=0,2 \end{cases}\Rightarrow \begin{cases} x=0,09375(mol)\\ y=0,10625(mol) \end{cases}\\ \Rightarrow \begin{cases} m_{Mg}=2,25(g)\\ m_{Ca}=4,25(g) \end{cases}\)

Chọn C
Các chất thỏa mãn : Al2O3 ; Zn(OH)2 ; NaHS ; (NH4)2CO3 ; Al

Đáp án : C
Tổng quát : M + 2H2O -> M(OH)2 + H2
=> nM = nH2 = 0,3 mol => Mtb = 29,33g
=> Mg(24) và Ca(40)

Gọi công thức chung cho hai kim loại kiềm là M
Số mol H2: nH2 = 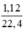 = 0,05(mol)
= 0,05(mol)
PTHH: 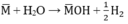
Theo pt: nM = 2. nH2 = 2. 0,05 = 0,1(mol)
⇒ M = 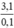 = 31 → Na, K
= 31 → Na, K
Gọi x, y lần lượt là số mol của Na và K trong hỗn hợp
Theo bài ra ta có hệ phương trình:
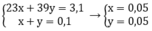
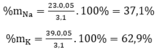

a)
\(n_{H_2}=\dfrac{0,56}{22,4}=0,025\left(mol\right)\)
PTHH: 2A + 2H2O --> 2AOH + H2
2B + 2H2O --> 2BOH + H2
=> nA + nB = 0,05 (mol)
\(\overline{M}=\dfrac{1,63}{0,05}=32,6\left(g/mol\right)\)
Mà 2 kim loại nằm ở 2 chu kì liên tiếp
=> 2 kim loại là Na, K
b)
Gọi số mol Na, K là a, b
=> 23a + 39b = 1,63
PTHH: 2Na + 2H2O --> 2NaOH + H2
______a------------------->a---->0,5a
2K + 2H2O --> 2KOH + H2
b----------------->b---->0,5b
=> 0,5a + 0,5b = 0,025
=> a = 0,02; b = 0,03
=> \(\left\{{}\begin{matrix}m_{Na}=0,02.23=0,46\left(g\right)\\m_K=0,03.39=1,17\left(g\right)\end{matrix}\right.\)
c) nNaOH = 0,02(mol); nKOH = 0,03(mol)
Gọi công thức chung là ROH
=> nROH = 0,02 + 0,03 = 0,05 (mol)
PTHH: ROH + HCl --> RCl + H2O
_____0,05-->0,05
=> \(V_{ddHCl}=\dfrac{0,05}{2}=0,025\left(l\right)\)
a, Ta có: \(n_{H_2}=\dfrac{3,7185}{24,79}=0,15\left(mol\right)\)
Giả sử 2 KL cần tìm là A.
PT: \(A+2HCl\rightarrow ACl_2+H_2\)
Theo PT: \(n_A=n_{H_2}=0,15\left(mol\right)\)
\(\Rightarrow M_A=\dfrac{4,4}{0,15}=29,33\left(g/mol\right)\)
Mà: 2 KL nằm ở 2 chu kì kế tiếp.
→ Mg và Ca.
b, Ta có: 24nMg + 40nCa = 4,4 (1)
BT e, có: 2nMg + 2Ca = 0,15.2 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Mg}=0,1\left(mol\right)\\n_{Ca}=0,05\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Mg}=0,1.24=2,4\left(g\right)\\m_{Ca}=0,05.40=2\left(g\right)\end{matrix}\right.\)