Cho 20,4 gam hỗn hợp X gồm Fe, Zn, Al tác dụng với dung dịch H2SO4 dư thu được 10,08 lít H2 (đktc). Mặt khác cho 0,2 mol X tác dụng vừa đủ với 6,16 lít Cl2 (đktc). Tính thành phần phần trăm khối lượng mỗi kim loại trong hỗn hợp X biết
Fe + Cl2 ® FeCl3
Zn + Cl2 ® ZnCl2
Al + Cl2 ® AlCl3


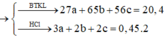
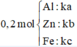
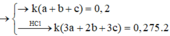
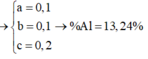

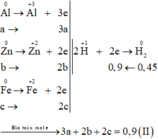
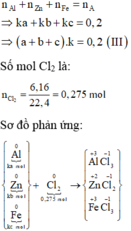
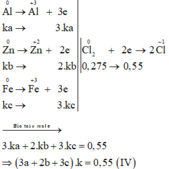


Gọi $n_{Fe} = a(mol), n_{Zn} = b(mol) , n_{Al} = c(mol) \Rightarrow 56a + 65b + 27c = 20,4(1)$
$Fe + H_2SO_4 \to FeSO_4 + H_2$
$Zn + H_2SO_4 \to ZnSO_4 + H_2$
$2Al +3 H_2SO_4 \to Al_2(SO_4)_3 +3 H_2$
Theo PTHH : $n_{H_2} = a + b + 1,5c = \dfrac{10,08}{22,4} = 0,45(mol)(2)$
Mặt khác :
$2Fe + 3Cl_2 \xrightarrow{t^o} 2FeCl_3$
$Zn + Cl_2 \xrightarrow{t^o} ZnCl_2$
$2Al + 3Cl_2 \xrightarrow{t^o} 2AlCl_3$
Theo PTHH : $n_{Cl_2} = 1,5n_{Fe} + n_{Zn} + 1,5n_{Al}$
Suy ra : \dfrac{1,5a + b + 1,5c}{a + b + c} = \dfrac{0,275}{0,2}(3)$
Từ (1)(2)(3) suy ra : a = 0,2 ; b = 0,1 ; c = 0,1
$\%m_{Fe} = \dfrac{0,2.56}{20,4}.100\% = 54,9\%$
$\%m_{Zn} = \dfrac{0,1.65}{20,4}.100\% = 31,9\%$
$\%m_{Al} = 100\% - 54,9\% - 31,9\% = 13,2\%$