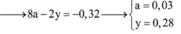Một hỗn hợp X gồm Al và Fe có khối lượng 19,3g. Cho hỗn hợp X tác dụng với dung dịch có chứa 1,5 mol \(H_2SO_4\)
a. X có tan hết không? Vì sao?
b. Tính khối lượng mỗi kim loại trong hỗn hợp X biết rằng lượng khí hidro tạo ra trong phản ứng tác dụng vừa đủ với 52g CuO
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
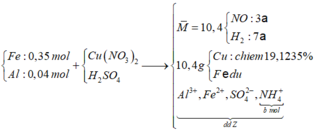
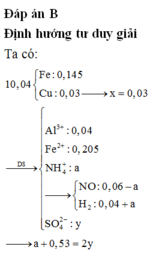
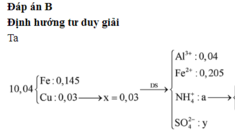
nCu = (10,4. 0,191235 )/64= 0,03 (mol) => nCu(NO3)2 = 0,03
=> nFe dư = ( 10,4 -0,03.64)/56 = 0,145 (mol) => nFe pư = 0,35 – 0,145 = 0,205 (mol)
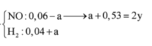
Hỗn hợp khí có M = 10,4 => Dùng quy tắc đường chéo => nNO = 3a và nH2 = 7a (mol)
Bảo toàn nguyên tố N ta có: nNO + nNH4+ = 2nCu(NO3)2
=> 3a + b = 0,03.2 (1)
Bảo toàn e: 2nFe pư + 3nAl = 3nNO + 2nH2 + 8nNH4+ + 2nCu2+
=> 2.0,205 + 3. 0,04 = 3.3a + 2.7a + 8b + 2. 0,03
=> 23a + 8b = 0,47 (2)
Từ (1) và (2) => a = 0,01 và b = 0,03 (mol)
Bảo toàn điện tích với dung dịch Y gồm Al3+ (0,04 ); Fe2+: (0,205); NH4+ (0,03) và SO42-
=> 3.0,04 + 2.0,205 = 0,03 + 2nSO4
=> nSO4 = 0,28 (mol)
=> mmuối = mAl3+ + mFe2+ + mNH4+ + mSO42-
= 0,04.27 + 0,205.56 + 0,03.18 + 0,28.96
= 39,98 (g)
% Al2(SO4)3 = (0,02. 342) :39,98 ).100% = 17,11% ≈ 17,15%

\(n_{Cu}=a\left(mol\right),n_{Fe}=b\left(mol\right),n_{Al}=c\left(mol\right)\)
\(m_X=64a+56b+27b=35.7\left(g\right)\left(1\right)\)
\(n_{Cl_2}=\dfrac{21.84}{22.4}=0.975\left(mol\right)\)
\(Cu+Cl_2\underrightarrow{^{^{t^0}}}CuCl_2\)
\(Fe+\dfrac{3}{2}Cl_2\underrightarrow{^{^{t^0}}}FeCl_3\)
\(Al+\dfrac{3}{2}Cl_2\underrightarrow{^{^{t^0}}}AlCl_3\)
\(n_{Cl_2}=a+1.5b+1.5c=0.975\left(mol\right)\left(2\right)\)
\(n_{hh}=ka+kb+kc=0.25\left(mol\right)\)
\(n_{H_2}=kb+k\cdot1.5c=0.2\left(mol\right)\)
\(\Leftrightarrow a-0.25b-0.875c=0\left(3\right)\)
\(\left(1\right),\left(2\right),\left(3\right):a=0.3,b=0.15,c=0.3\)
\(\%Cu=\dfrac{0.3\cdot64}{35.7}\cdot100\%=53.78\%\)
\(\%Fe=\dfrac{0.15\cdot56}{35.7}\cdot100\%=23.52\%\)
\(\text{%Al=22.7%}\)

Đáp án : A
Trong 53,75g X có x mol Sn ; y mol Fe ; z mol Al
=> t(119x + 56y + 27z) = 53,75g
X + Cl2 -> SnCl4 ; FeCl3 ; AlCl3
⇒ t 4 x + 3 y + 3 z = 2 n C l 2 = 2 , 25 m o l
(Trong 0,4 mol lượng chất gấp t lần)
=> 9(119x + 56y + 27z) = 215(4x + 3y + 3z)
=> 211x – 141y – 402z = 0(1)
=> x + y + z = 0,4 mol(2)
n H 2 = x + y + 1,5z = 31/70 (mol) (3)
Từ (1,2,3) => z = 0,0857 mol
=> mAl = 2,314g

* Xác định số mol mỗi khí trong hỗn hợp Y (số liệu nào tính được ngay thì tính trước):
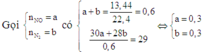
* Biện luận dựa vào giả thiết để tìm khối lượng mỗi kim loại phản ứng:
Vì đề bài nêu rõ sau phản ứng còn một chất rắn không tan nên kim loại dư sau phản ứng. Khi đó ta không thể dựa vào giả thiết về tổng khối lượng hai kim loại và số mol khí sản phẩm khử để lập hệ hai phương trình hai ẩn để giải số mol mỗi kim loại.
Ngoài ra, vì Al có tính khử mạnh hơn Cu nên Al phản ứng trước. Do đó kim loại còn dư là Cu.
Tiếp theo với giả thiết mỗi kim loại chỉ tạo một khí ta sẽ liên hệ áp dụng với phần lí thuyết về sản phẩm khí có thể sinh ra: Vì Cu là kim loại có tính khử yếu hơn Fe (Cu đứng sau Fe trong dãy hoạt động hóa học của kim loại) nên theo lí thuyết, khi Cu phản ứng với dung dịch HNO3 thì sản phẩm khử sinh ra là NO mà không thể là N2. Do đó ở bài tập này, Al đã phản ứng với dung dịch HNO3 sinh ra khí N2.
* Áp dụng kết quả biện luận để tính toán theo yêu cầu đề bài:
Theo định luật bảo toàn mol electron ta có:
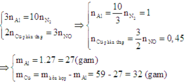
Để tính được nồng độ mol của dung dịch HNO3 đã dùng khi đã biết thể tích, ta cần tìm được số mol của HNO3 trong dung dịch.
Sau khi đã biết số mol các kim loại tham gia phản ứng, các bạn có thể viết cụ thể phương trình phản ứng để tính số mol HNO3 theo số mol kim loại hoặc khí:

Đáp án A.

Gọi $n_{Fe} = a(mol), n_{Zn} = b(mol) , n_{Al} = c(mol) \Rightarrow 56a + 65b + 27c = 20,4(1)$
$Fe + H_2SO_4 \to FeSO_4 + H_2$
$Zn + H_2SO_4 \to ZnSO_4 + H_2$
$2Al +3 H_2SO_4 \to Al_2(SO_4)_3 +3 H_2$
Theo PTHH : $n_{H_2} = a + b + 1,5c = \dfrac{10,08}{22,4} = 0,45(mol)(2)$
Mặt khác :
$2Fe + 3Cl_2 \xrightarrow{t^o} 2FeCl_3$
$Zn + Cl_2 \xrightarrow{t^o} ZnCl_2$
$2Al + 3Cl_2 \xrightarrow{t^o} 2AlCl_3$
Theo PTHH : $n_{Cl_2} = 1,5n_{Fe} + n_{Zn} + 1,5n_{Al}$
Suy ra : \dfrac{1,5a + b + 1,5c}{a + b + c} = \dfrac{0,275}{0,2}(3)$
Từ (1)(2)(3) suy ra : a = 0,2 ; b = 0,1 ; c = 0,1
$\%m_{Fe} = \dfrac{0,2.56}{20,4}.100\% = 54,9\%$
$\%m_{Zn} = \dfrac{0,1.65}{20,4}.100\% = 31,9\%$
$\%m_{Al} = 100\% - 54,9\% - 31,9\% = 13,2\%$

1. Gọi nAl = a (mol)
=> nFe = 1,5a (mol)
PTHH:
2Al + 3H2SO4 -> Al2(SO4)3 + 3H2
a ---> 1,5a ---> a ---> 1,5a
Fe + H2SO4 -> FeSO4 + H2
1,5a ---> 1,5a ---> 1,5a ---> 1,5a
=> 342a + 152 . 1,5a = 39,9
=> a = 0,07 (mol)
mAl = 0,07 . 27 = 1,89 (g)
mFe = 0,07 . 1,5 . 56 = 5,88 (g)
2. nH2 = 1,5 . 0,07 + 1,5 . 0,07 = 0,21 (mol)
nO2 = 0,21 . 2 = 0,42 (mol)
nH2O = 2,7/18 = 0,15 (mol)
PTHH: 2H2 + O2 -> (t°) 2H2O
Mol: 0,15 <--- 0,075 <--- 0,15
VE = (0,21 - 0,15 + 0,42 - 0,075) . 22,4 = 9,072 (l)
mE = (0,42 - 0,075) . 32 + (0,21 - 0,15) . 2 = 11,14 (g)
nE = 0,42 - 0,075 + 0,21 - 0,15 = 0,405 (mol)
M(E) = 11,14/0,405 = 27,5 (g/mol)
d(E/N2) = 27,5/28 = 0,98