cho 100ml dd KOH 1M phản ứng với 200ml dd H2SO4 nồng độ 2M a) hỏi sau phản ứng chất nào dư, dư bao nhiêu b) tính nồng độ mol của dd sau phản ứng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

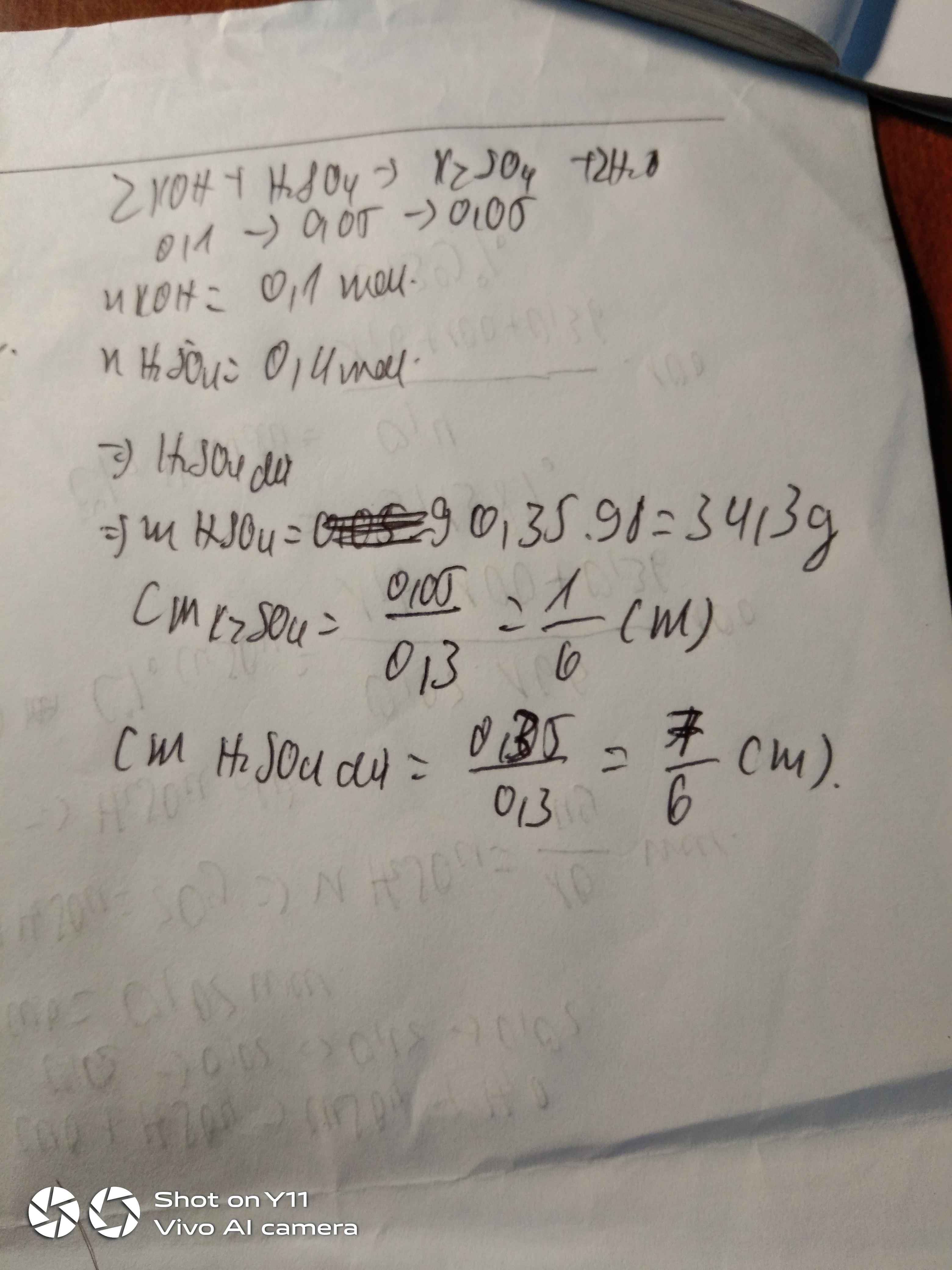

Ta có: \(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
\(n_{HCl}=0,1.1=0,1\left(mol\right)\)
PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
Xét tỉ lệ: \(\dfrac{0,1}{1}>\dfrac{0,1}{2}\), ta được Fe dư.
a, Theo PT: \(n_{H_2}=\dfrac{1}{2}n_{HCl}=0,05\left(mol\right)\)
⇒ VH2 = 0,05.22,4 = 1,12 (l)
b, Sau pư, Fe dư.
Theo PT: \(n_{Fe\left(pư\right)}=\dfrac{1}{2}n_{HCl}=0,05\left(mol\right)\Rightarrow n_{Fe\left(dư\right)}=0,1-0,05=0,05\left(mol\right)\)
⇒ mFe (dư) = 0,05.56 = 2,8 (g)
c, Theo PT: nFeCl2 = nFe (pư) = 0,05 (mol)
\(\Rightarrow C_{M_{FeCl_2}}=\dfrac{0,05}{0,1}=0,5M\)
Bạn tham khảo nhé!
\(n_{Fe}=\dfrac{5.6}{56}=0.1\left(mol\right)\)
\(n_{HCl}=0.1\cdot1=0.1\left(mol\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(\dfrac{n_{Fe}}{1}=0.1>\dfrac{n_{HCl}}{2}=\dfrac{0.1}{2}=0.05\)
\(\Rightarrow Fedư\)
\(V_{H_2}=0.05\cdot22.4=1.12\left(l\right)\)
\(m_{Fe\left(dư\right)}=\left(0.1-0.05\right)\cdot56=2.8\left(g\right)\)
\(C_{M_{FeCl_2}}=\dfrac{0.05}{0.1}=0.5\left(M\right)\)

PTHH: \(2KOH+H_2SO_4\rightarrow K_2SO_4+2H_2O\)
Ta có: \(n_{KOH}=0,2\cdot0,5=0,1\left(mol\right)\)
\(\Rightarrow n_{H_2SO_4}=n_{K_2SO_4}=0,05\left(mol\right)\) \(\Rightarrow\left\{{}\begin{matrix}C_{M_{H_2SO_4}}=\dfrac{0,05}{0,1}=0,5\left(M\right)\\C_{M_{K_2SO_4}}=\dfrac{0,05}{0,2+0,1}\approx0,17\left(M\right)\end{matrix}\right.\)
Bài 1 :
200ml = 0,2l
100ml = 0,1l
\(n_{KOH}=0,5.0,2=0,1\left(mol\right)\)
a) Pt : \(2KOH+H_2SO_4\rightarrow K_2SO_4+2H_2O|\)
2 1 1 2
0,1 0,05 0,05
b) \(n_{H2SO4}=\dfrac{0,1.1}{2}=0,05\left(mol\right)\)
\(C_{M_{ddH2SO4}}=\dfrac{0,05}{0,1}=0,5\left(M\right)\)
c) \(n_{K2SO4}=\dfrac{0,05.1}{1}=0,05\left(mol\right)\)
\(V_{ddspu}=0,2+0,1=0,3\left(l\right)\)
\(C_{M_{K2SO4}}=\dfrac{0,05}{0,3}=\dfrac{1}{6}\left(M\right)\)
Chúc bạn học tốt

PTHH: \(H_2SO_4+2KOH\rightarrow K_2SO+2H_2O\)
Ta có: \(n_{H_2SO_4}=0,2\cdot1=0,2\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{KOH}=0,4\left(mol\right)\\n_{K_2SO_4}=0,2\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}V_{ddKOH}=\dfrac{\dfrac{0,4\cdot56}{6\%}}{1,048}\approx356,2\left(ml\right)\\C_{M_{K_2SO_4}}=\dfrac{0,2}{0,2+0,3562}\approx0,36\left(M\right)\end{matrix}\right.\)
\(n_{H_2SO_4}=1.0,2=0,2\left(mol\right)\\ H_2SO_4+2KOH\rightarrow K_2SO_4+2H_2O\\ 0,2.........0,4........0,2.......0,2\left(mol\right)\\ a.m_{ddKOH}=\dfrac{0,4.56.100}{6}=\dfrac{1120}{3}\left(g\right)\\ V_{ddKOH}=\dfrac{\dfrac{1120}{3}}{1,048}=\dfrac{140000}{393}\left(ml\right)\approx0,356\left(l\right)\)
\(b.C_{MddK_2SO_4}=\dfrac{0,2}{\dfrac{140000}{393}+0,2}\approx0,00056\left(M\right)\)

PT: \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
a, Ta có: \(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\)
\(n_{H_2SO_4}=0,2.1=0,2\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,1}{1}< \dfrac{0,2}{1}\). ta được H2SO4 dư.
Theo PT: \(n_{H_2SO_4\left(pư\right)}=n_{ZnSO_4}=n_{Zn}=0,1\left(mol\right)\)
\(\Rightarrow n_{H_2SO_4\left(dư\right)}=0,2-0,1=0,1\left(mol\right)\)
b, Ta có: \(m_{ZnSO_4}=0,1.161=16,1\left(g\right)\)
c, \(C_{M_{H_2SO_4\left(dư\right)}}=\dfrac{0,1}{0,2}=0,5M\)
\(C_{M_{ZnSO_4}}=\dfrac{0,1}{0,2}=0,5M\)
Bạn tham khảo nhé!

\(n_{KOH}=0,2.0,2=0,04(mol); n_{H_3PO_4}=0,15.0,15=0,0225(mol)\\ \Rightarrow \dfrac{n_{KOH}}{n_{H_3PO_4}}=\dfrac{0,04}{0,0225} \Rightarrow 1<\dfrac{n_{KOH}}{n_{H_3PO_4}}<2\)
\(\Rightarrow \) Tạo 2 muối \(K_2HPO_4,KH_2PO_4\)
Đặt \(\begin{cases} n_{KH_2PO_4}=x(mol)\\ n_{K_2HPO_4}=y(mol) \end{cases}\)
Bảo toàn K: \(x+2y=0,04(1)\)
Bảo toàn P: \(x+y=0,0225(2)\)
\((1)(2)\Rightarrow \begin{cases} x=0,005(mol)\\ y=0,0175(mol) \end{cases}\\ \Rightarrow \begin{cases} C_{M_{KH_2PO_4}}=\dfrac{0,005}{0,2+0,15}\approx 0,014M\\ C_{M_{K_2HPO_4}}=\dfrac{0,0175}{0,2+0,15}=0,05M \end{cases}\)
