Đem 17,8 gam hỗn hợp hai kim loại Mg và Zn chia làm 2 phần bằng nhau: ▪ Phần 1: Cho tác dụng với 0,2 lít dung dịch H2SO4 aM thoát ra 0,15 mol H2 ▪ Phần 2: Cho tác dụng với 0,3 lít dung dịch H2SO4 aM thoát ra 0,2 mol H2
Tất cả phản ứng xảy ra hoàn toàn.
a. Tính aM.
b. Tính khối lượng từng kim loại trong hỗn hợp ban đầu.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{H_2}=0.065\left(mol\right)\)
\(2H^++2e\rightarrow H_2\)
\(O_2+4e\rightarrow2O^{2-}\)
\(n_{O_2}=\dfrac{2\cdot0.065}{4}=0.0325\left(mol\right)\)
\(BTKL:\)
\(m_{oxit}=\dfrac{2.29}{2}+0.0325\cdot32=2.185\left(g\right)\)

1.1. Al + NaOH + H2O ==> NaAlO2 + 3/2H2
nH2(1)=3,36/22,4=0.15(mol)
=> nAl(1)= nH2(1):3/2= 0.15:3/2= 0.1(mol)
2.Mg + 2HCl ==> MgCl2 + H2
3.2Al + 6HCl ==> 2AlCl3 + 3H2
4.Fe + 2HCl ==> FeCl2 + H2
=> \(n_{H_2\left(2,3,4\right)}=\) 10.08/22.4= 0.45(mol)
=> nH2(3)=0.1*3/2=0.15(mol)
MgCl2 + 2NaOH ==> Mg(OH)2 + 2NaCl
AlCl3 + 3NaOH ==> Al(OH)3 + 3NaCl
FeCl2 + 2NaOH ==> Fe(OH)2 + 2NaCl

Gọi $n_{Mg} = a(mol) ; n_{Fe} = b(mol)$
Muối gồm :
$Mg(NO_3)_2 : a(mol)$
$Fe(NO_3)_3 : b(mol)$
$\Rightarrow 148a + 242b = 49,1(1)$
Bảo toàn electron : $2n_{Mg} + 3n_{Fe} = 2a + 3b = n_{NO_2} = 0,65(2)$
Từ (1)(2) suy ra a = 0,25 ; b = 0,05
$\%m_{Mg} = \dfrac{0,25.24}{0,25.24 + 0,05.56}.100\% = 68,18\%$
$\%m_{Fe} = 100\% -68,18\% = 31,82\%$

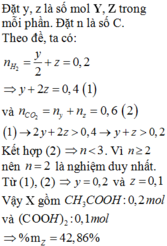






Chia làm hai phần bằng nhau mỗi phần co 8,9g hỗn hợp.
Phần 1:
\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
x x x
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
y y y
\(\left\{{}\begin{matrix}24x+65y=8,9\\x+y=0,15\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=\dfrac{17}{820}\\y=\dfrac{53}{410}\end{matrix}\right.\)
\(\Rightarrow n_{H_2SO_4}=\dfrac{17}{820}+\dfrac{53}{410}=0,15mol\)
\(a=C_{M_{H_2SO_4}}=\dfrac{0,15}{0,2}=0,75M\)
\(m_{Mg}=2\cdot\dfrac{17}{820}\cdot24=1g\)
\(\Rightarrow m_{Zn}=17,8-1=16,8g\)