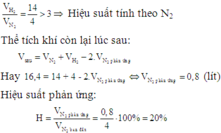cho 4 lít khí nitơ và 14 lít khí hidro vào bình kín rồi nung nóng với xúc tác thích hợp để phản ứng xảy ra sau phản ứng thu được 16,4 lít hỗn hợp khí ( các khí đo ở cùng điều kiện nhiệt độ và áp suất ) a, Tính V khí amoniac thu dc ?
b, Xác định H% cuả phản ứng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) PTHH: N2+ 3H2 ⇌ 2NH3
Ở cùng điều kiện thì tỉ lệ về thể tích chính là tỉ lệ về số mol
Đặt thể tích N2 phản ứng là x (lít)
=> VH2 pứ= 3x (lít) , VNH3 sinh ra=2x (lít)
VN2 dư= 4-x (lít), VH2 dư= 14-3x (lít)
Sau phản ứng thu được N2 dư, H2 dư, NH3
Tổng thể tích khí thu được sau phản ứng là:
V khí= VH2 dư+ VN2 dư+ VNH3= 14-3x + 4-x+ 2x= 16,4
=> x=0,8 lít
=>VNH3 sinh ra= 2x = 2.0,8 =1,6 (lít)
b)Do \(\dfrac{4}{1}< \dfrac{14}{3}\) =>Hiệu suất tính theo N2
=>H=\(\dfrac{V_{N_2\left(pứ\right)}}{V_{N_2\left(bđ\right)}}\)⋅100=\(\dfrac{0,8}{4}.100\)=20%

Ta có: \(n_{N_2}=0,2\left(mol\right)\)
\(n_{H_2}=0,3\left(mol\right)\)
PT: \(N_2+3H_2⇌2NH_3\)
Xét tỉ lệ: \(\dfrac{0,2}{1}>\dfrac{0,3}{1}\)
Vậy: Nếu pư hoàn toàn thì H2 hết.
⇒ Tính theo số mol H2.
Mà: H% = 25%
\(\Rightarrow n_{H_2\left(pư\right)}=0,3.25\%=0,075\left(mol\right)\)
Theo PT: \(n_{NH_3}=\dfrac{2}{3}n_{H_2}=0,05\left(mol\right)\)
\(\Rightarrow V_{NH_3}=0,05.22,4=1,12\left(l\right)\)
Bạn tham khảo nhé!

Đáp án : C
Ta có Cùng điều kiện -> Quy số lít về số mol.n(hh ban đầu) = 20 mol; n(hh sau) = 16 lít
=> H2 phản ứng mất 4 lít => C2H2 có 2 lít và CH4 có 8 lít