Bài 8 : Cho 13 gam kim loại R (II) phản ứng vừa đủ với dd chứa 14,6(g) axitclohiđric (HCl). Sau PƯ thu được khí H2 và dung dịch muối clorua (RCl2)
a. Tìm kim loại R b.Tính VH2 thu được ở đktc
c. Tính khối lượng muối thu được.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn A

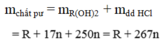
Vì phản ứng không sinh ra chất khí hay kết tủa
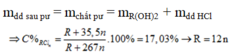
Vậy n = 2, R = 24 g/mol thỏa mãn, chất cần tìm là M g O H 2 .

\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: R + 2HCl --> RCl2 + H2
0,2<-----------------0,2
=> \(M_R=\dfrac{13}{0,2}=65\left(g/mol\right)\)
=> R là Zn

Gọi hóa trị kim loại R là n
\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
\(2R+nH_2SO_4\rightarrow R_2\left(SO_4\right)_n+nH_2\)
\(\dfrac{0,15}{n}\) 0,15 ( mol )
\(M_{R_2\left(SO_4\right)_n}=\dfrac{22,8}{\dfrac{0,15}{n}}=152n\)
\(\Leftrightarrow2R+96n=152n\)
\(\Leftrightarrow R=28n\)
`@n=1->` Loại
`@n=2->` R là Sắt ( Fe )
`@n=3->` Loại
Vậy R là Fe
\(n_{HCl}=\dfrac{14,6}{36,5}=0,4\left(mol\right)\)
\(PTHH:R+2HCl\rightarrow RCl_2+H_2\uparrow\\ Mol:0,2\leftarrow0,4\rightarrow0,2\rightarrow0,2\)
=> MR = \(\dfrac{13}{0,2}=65\left(\dfrac{g}{mol}\right)\)
=> R là Zn
=> \(\left\{{}\begin{matrix}V_{H_2}=0,2.22,4=4,48\left(l\right)\\m_{ZnCl_2}=0,2.136=27,2\left(g\right)\end{matrix}\right.\)
nHCL = 14,6 : 36,5 = 0,4 (MOL)
pthh : 2R + 2xHCl ---> 2RClx + xH2
0,4x<--0,4 (mol)
MR = 13:0,4x = 32,5x(g/mol)
xét
x = 1 (KTM )
x= 2 (TM )
x = 3 (KTM )
x =4( KTM )
x= 5 (ktm )
x=6 (ktm)
x=7 (ktm )
=> R là zn