Chia 35 8 gam hỗn hợp x gồm Al, Fe, Cu thành 2 phần bằng nhau: Phần 1: cho tác dụng với dung dịch H2SO4 đặc nguội thì thu được 3,36 lít khí SO2 (ở đktc) Phần 2: cho tác dụng với dung dĩhj H2SO4 loãng thấy thoát ra 5,6 lít khí H2 (ở đktc) Tính khối lượng kim loại trong X. Mong mn trả giúp e sớm tại e sắp thi giữa kỳ r =((
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Chọn B
Phần I. Cho X tác dụng với HNO 3 đặc, nguội chỉ có Cu phản ứng.
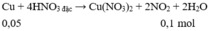
Phần II. Cho X tác dụng với H 2 SO 4 loãng, dư chỉ có Fe phản ứng
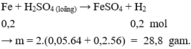

Các PTHH :
2Al + 3 H 2 SO 4 → Al 2 SO 4 3 + 3 H 2 (1)
2Al + 6 H 2 SO 4 → Al 2 SO 4 3 + 3 SO 2 + 6 H 2 O (2)
Cu + 2 H 2 SO 4 → Cu SO 4 + 2 H 2 O + SO 2 (3)
Theo PTHH (1) số mol Al tham gia phản ứng bằng 2/3 số mol H 2 => Khối lượng AI trong hỗn hợp : 2×2/3×0,06×27 = 2,16(g)
Số mol SO 2 được giải phóng bởi Al: 2,16/27 x 3/2 = 0,12 mol
Theo PTHH (2) và (3) số mol SO 2 giải phóng bởi Cu : 2.0,1 - 0,12 = 0,08 (mol)
Theo PTHH (3) khối lượng Cu trong hỗn hợp : 0,08. 64 = 5,12 (g)
Vậy m = 2,16 + 5,12 = 7,28 (g).

Đáp án C
P1 : Chỉ có Cu phản ứng được với HNO3 đặc nguội
Bảo toàn e : 2nCu = nNO2 = 0,03 mol
P2 : Chỉ có Fe phản ứng với H2SO4 loãng dư
=> nFe = nH2 = 0,02 mol
=> m = 2. (0,015.64 + 0,02.56) = 4,16g

Chọn đáp án C
Phần 1: tác dụng với HNO3 đặc, nguội ⇒ Fe không phản ứng, sản phẩm khử là NO2 (do dùng HNO3 đặc).
⇒ Bảo toàn electron có: 2nCu = nNO2 = 0,03 mol ⇒ nCu = 0,015 mol.
Phần 2: tác dụng với H2SO4 loãng ⇒ Cu không phản ứng, chỉ có Fe phản ứng:
Fe + H2SO4 → FeSO4 + H2↑ ||⇒ nFe = 0,02 mol.
Theo đó, m = 2 × (0,015 × 64 + 0,02 × 56) = 4,16 gam (tránh quên × 2 do chia đôi)

Phần 1: tác dụng với HNO3 đặc, nguội ⇒ Fe không phản ứng, sản phẩm khử của N + 5 là NO2 (do dùng HNO3 đặc).
⇒ Bảo toàn electron có: 2nCu = n NO 2 = 0,03 mol
⇒ nCu = 0,015 mol.
Phần 2: tác dụng với H2SO4 loãng ⇒ Cu không phản ứng, chỉ có Fe phản ứng:
Fe + H2SO4 → FeSO4 + H2↑
⇒ nFe = n H 2 = 0,02 mol.
Theo đó, m = 2 × (0,015 × 64 + 0,02 × 56) = 4,16 gam
Đáp án C

Xét thí nghiệm 2: chú ý tính thụ động hóa của kim loại:
H2SO4 đặc, nguội không phản ứng với Al, Cr, Fe!
⇒ trong X chỉ có Cu phran ứng. Bảo toàn electron: n Cu = n SO 2 = 0 , 075 mol.
Đặt n Cr = x mol; n Fe = y mol → m X 52x + 56y + 0,075 × 64 = 18,2 gam.
x + y = 0,25 mol. Giải hệ có: x = 0,15 mol; y = 0,1 mol.
mCr trong X = 42,86% và %mCu trong X = 26,37%
Đáp án A

Chọn đáp án A
Xét thí nghiệm 2: chú ý tính thụ động hóa của kim loại:
H2SO4 đặc, nguội không phản ứng với Al, Cr, Fe!
⇒ trong X chỉ có Cu phran ứng. Bảo toàn electron: n C u = n S O 2 = 0 , 075 m o l
Đặt nCr = x mol; nFe = y mol ⇒ m X = 52x + 56y + 0,075 × 64 = 18,2 gam.
nH2 = x + y = 0,25 mol. Giải hệ có: x = 0,15 mol; y = 0,1 mol.
⇒ % mCr trong X = 42,86% và %mCu trong X = 26,37%
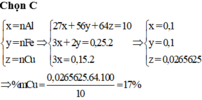
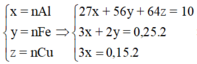
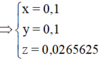
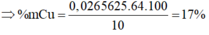
\(\text{Mỗi phần,gọi :} n_{Al} = a ; n_{Fe} = b ; n_{Cu} = c\\ \Rightarrow 27a + 56b + 64c = \dfrac{35,8}{2} = 17,9(1)\\ \text{Phần 1 : Al,Fe không phản ứng với axit đặc nguội}\\ Cu + 2H_2SO_4 \to CuSO_4 + SO_2 + H_2O\\ n_{Cu} = c = n_{SO_2} = \dfrac{3,36}{22,4} = 0,15(2)\\ \text{Phần 2 : Cu không phản ứng với axit loãng}\\ 2Al + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2\\ Fe + H_2SO_4 \to FeSO_4 + H_2\\ n_{H_2} = 1,5a + b = \dfrac{5,6}{22,4} = 0,25(3)\\ (1)(2)(3) \Rightarrow a = b = 0,1 ; c = 0,15\)
Suy ra :
\(m_{Al} = 0,1.2.27 = 5,4(gam)\\ m_{Fe} = 0,1.2.56 = 11,2(gam)\\ m_{Cu} = 0,15.64.2 = 19,2(gam)\)