cho m gam kim loại fe,mg,zn,ca,cu và al vào 1 bình kín có chứa 1 mol oxi.Nung nóng bình 1 thời gian cho đến khi ngừng phản ứng thì thể tích oxi giảm đi 3,5% và thu được 2,12 gam chất rắn.Tính m ( biết thể tích các khí đo ở cùng điều kiện về nhiệt độ và áp suất)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a)
2Fe + O2 --to--> 2FeO
3Fe + 2O2 --to--> Fe3O4
4Fe + 3O2 --to--> 2Fe2O3
2Cu + O2 --to--> 2CuO
4Al + 3O2 --to--> 2Al2O3
b)
Thể tích khí trong bình giảm còn 20%
=> Có 80% thể tích khí O2 tham gia pư
=> Có 80% số mol khí O2 tham gia pư
\(n_{O_2\left(pư\right)}=\dfrac{8}{32}.80\%=0,2\left(mol\right)\)
Theo ĐLBTKL: mrắn bđ + mO2(pư) = mrắn sau pư
=> m + 0,2.32 = 24,05
=> m = 17,65 (g)

n O2 pư= 0,9 - 0,865 = 0,035 mol
=> mkim loại = m chất rắn - m oxi pư = 2,12 - 0,035.32 = 2,05 (g)

noxi phản ứng = \(\frac{3,5}{100}\) = 0,035 (mol)
=> moxi phản ứng = 0,035 x 32 = 1,12 (g)
ta có: mchất rắn = mkim loại + mo2 phản ứng
=> m (mkim loại) = 2,12 – 1,12 = 1 (g).

Kim loại không tan là Cu dư.
Cu dư => Muối thu được gồm FeCl2 và CuCl2 vì: Cu + 2FeCl3 → CuCl2 + 2FeCl2
Số mol các chất là: 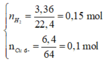
Sơ đồ phản ứng:
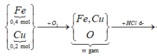
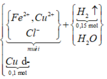
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Đáp án A.

Đáp án C

- Sau điện phân:
+ Thể tích dung dịch NaOH ở bình 1 = 0 , 0692 2 =0,03461=34,6 ml
=> Thể tích nước bị điện phân = 40 - 34,6 = 5,4 ml
=> Số mol nước bị điện phân ở bình 1 = 5 , 4 18 = 0,3 mol
+ Bình 2:
n Cu = n H 2 O điện phân ( I ) = 0 , 3 mol ⇒ n Cu 2 + dư = 0 , 45 - 0 , 3 = 0 , 15 mol n Cl 2 = 1 2 n Cl - = 0 , 2 mol ⇒ n H 2 O điện phân ( 1 ) = 0 , 3 - 0 , 2 = 0 , 1 mol ⇒ n H + = 0 , 2 + 0 , 4 = 0 , 6 mol
- Cho 0,5 mol Fe vào dung dịch bình 2 sau phản ứng điện phân
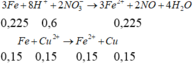
=> m = 56.(0,5-0,225-0,15)+64.0,15=16,6 gam gần với giá trị 17 nhất
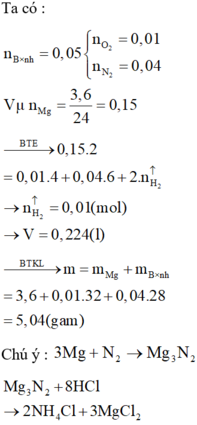

\(n_{O_2\left(pư\right)}=\dfrac{1.3,5}{100}=0,035\left(mol\right)\)
=> m = 2,12 - 0,035.32 = 1 (g)
nO2 (phản ứng) = 1 . 3,5% = 0,035 (mol)
mO2 (phản ứng) = 0,035 . 32 = 1,12 (g)
Áp dụng ĐLBTKL, ta có:
mkl + mO2 = moxit
=> mol = 2,12 - 1,12 = 1 (g)