Đốt cháy hoàn toàn hỗn hợp gồm FeS2, Ag2S được chất rắn A và khí B. Hấp thụ hết B vào dung dịch Brom vừa đủ, được dung dịch C. Cho toàn bộ A vào dung dịch C. Viết các phương trình phản ứng xảy ra.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(4FeS_2+11O_2\underrightarrow{t^0}2Fe_2O_3+8SO_2\)
\(Ag_2S+O_2\underrightarrow{t^0}2Ag+SO_2\)
\(A:Fe_2O_3,Ag\)
\(SO_2+Br_2+H_2O\rightarrow H_2SO_4+2HBr\)
\(B:H_2SO_4,HBr\)
\(Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2\)
\(Fe_2O_3+6HBr\rightarrow2FeBr_3+3H_2O\)

a)
\(4FeCO_3 + O_2 \xrightarrow{t^o} 2Fe_2O_3 + 4CO_2\\ 4FeS_2 + 11O_2 \xrightarrow{t^o} 2Fe_2O_3 + 8SO_2\\ SO_2 + Br_2 + 2H_2O \to 2HBr + H_2SO_4\\ Fe_2O_3 + 3H_2SO_4 \to Fe_2(SO_4)_3 + 3H_2O\)
\(n_{FeCO_3} = a ; n_{FeS_2} = b \Rightarrow 116a + 120b = 35,2(1)\\ n_{khí} = n_{CO_2} + n_{SO_2} = a + 2b = \dfrac{8,96}{22,4} = 0,4(2)\\ (1)(2)\Rightarrow a = 0,2 ; b = 0,1\\ \%m_{FeCO_3} = \dfrac{0,2.116}{35,2} .100\% =65,91\%\\ \%m_{Fe_2O_3} = 100\% - 65,91\% = 34,09\%\)
b) Không có chất rắn nào còn lại trong dung dịch Z

M + 2HCl → MCl2 + H2↑
MO + 2HCl → MCl2 + H2O
MCl2 + 2NaOH → M(OH)2↓ + 2NaCl
M(OH)2 → MO + H2O
M + CuCl2 → MCl2 + Cu↓


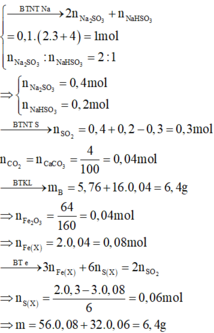

Đốt cháy:
\(4FeS_2+11O_2\underrightarrow{t^o}2Fe_2O_3+8SO_2\)
\(Ag_2S+O_2\underrightarrow{t^o}2Ag+SO_2\)
\(\Rightarrow A\left\{{}\begin{matrix}Fe_2O_3\\Ag\end{matrix}\right.\)
\(B:SO_2\)
\(SO_2+Br_2+H_2O\rightarrow H_2SO_4+HBr\)
Dung dịch C \(\left\{{}\begin{matrix}H_2SO_4\\HBr\end{matrix}\right.\)
Cho A vào ddC:
\(Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2\)
\(Fe_2O_3+6HBr\rightarrow2FeBr_3+3H_2O\)