Nhiệt phân 15,8 g kmno4 thu đc khí o2 . Hỏi a, viết pthh xảy ra b, tính thể tích khí o2 thu đc c, đốt cháy 5,6 g Fe trong o2 thu đc .tính khối lượng axit sắt từ thu đc
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\\a, PTHH:4Al+3O_2\rightarrow\left(t^o\right)2Al_2O_3\\ b,n_{O_2}=\dfrac{3}{4}.n_{Al}=\dfrac{3.0,2}{4}=0,15\left(mol\right)\\ \Rightarrow V_{O_2\left(đktc\right)}=0,15.22,4=3,36\left(l\right)\\ c,2KMnO_4\rightarrow\left(t^o\right)K_2MnO_4+MnO_2+O_2\\ n_{KMnO_4}=2.n_{O_2}=2.0,15=0,3\left(mol\right)\\ \Rightarrow m_{KMnO_4}=158.0,3=47,4\left(g\right)\)

\(n_{Zn}=\dfrac{m_{Zn}}{M_{Zn}}=\dfrac{19,5}{65}=0,3mol\)
\(Zn+\dfrac{1}{2}O_2\rightarrow\left(t^o\right)ZnO\)
1 1/2 1 (mol)
0,3 0,15 0,3 ( mol )
PƯ trên thuộc loại phản ứng hóa hợp
\(m_{ZnO}=n_{ZnO}.M_{ZnO}=0,3.81=24,3g\)
\(V_{O_2}=n_{O_2}.22,4=0,15.22,4=3,36l\)

a, 3Fe + 2O2 -to-> Fe3O4
b, nFe = m/M = 16,8/56 = 0,3 (mol)
từ pthh ta có: \(n_{O_2}=\dfrac{0,3.2}{3}=0,2\left(mol\right)\)
=>\(V_{O_2}=n.22,4=0,2.22,4=4,48\left(l\right)\)
c, C1: từ pthh ta có: \(n_{Fe_3O_4}=\dfrac{0,3.1}{3}=0,1\left(mol\right)\)
=>\(m_{Fe_3O_4}=n.M=0,1.\left(56.3+4.16\right)=0,1.232=23,2\left(g\right)\)
C2: \(m_{O_2}=n.M=0,2.32=6,4\left(g\right)\)
Áp dụng ĐLBTKL ta co:
\(m_{Fe_3O_4}=m_{Fe}+m_{O_2}=16,8+6,4=23,2\left(g\right)\)

Ta có: \(n_P=\dfrac{6,2}{31}=0,2\left(mol\right)\)
a. \(PTHH:4P+5O_2\overset{t^o}{--->}2P_2O_5\)
Theo PT: \(n_{O_2}=\dfrac{5}{4}.n_P=\dfrac{5}{4}.0,2=0,25\left(mol\right)\)
\(\Rightarrow V_{O_2}=0,25.22,4=5,5\left(lít\right)\)
b. Theo PT: \(n_{P_2O_5}=\dfrac{1}{2}.n_P=\dfrac{1}{2}.0,2=0,1\left(mol\right)\)
\(\Rightarrow m_{P_2O_5}=0,1.142=14,2\left(g\right)\)
\(n_P=\dfrac{6,2}{31}=0,2\left(mol\right)\\ 4P+5O_2-^{t^o}\rightarrow2P_2O_5\\ a.n_{O_2}=\dfrac{5}{4}n_P=0,25\left(mol\right)\\ \Rightarrow m_{O_2}=0,25.32=8\left(g\right)\\ b.BTKLm_P+m_{O_2}=m_{P_2O_5}\\ \Rightarrow m_{P_2O_5}=6,2+8=14,2\left(g\right)\)

Bài 4 câu a đề là thể tích H2 nha bạn
a)\(Fe2O3+3H2-->2Fe+3H2O\)
\(n_{Fe2O3}=\frac{12}{160}=0,075\left(mol\right)\)
\(n_{H2}=3n_{Fe2O3}=0,225\left(mol\right)\)
\(V_{H2}=0,225.22,4=5,04\left(l\right)\)
b)\(n_{Fe}=2n_{Fe2O3}=0,15\left(mol\right)\)
\(m_{Fe}=0,15.56=8,4\left(g\right)\)
Bài 6
a)\(Zn+H2SO4-->ZnSO4+H2\)
\(n_{Zn}=\frac{19,5}{65}=0,3\left(mol\right)\)
\(n_{ZnSO4}=n_{Zn}=0,3\left(mol\right)\)
\(m_{ZnSO4}=0,3.162=48,3\left(g\right)\)
b)\(n_{H2}=n_{Zn}=0,3\left(mol\right)\)
\(V_{H2}=0,3.22,4=6,72\left(l\right)\)

a/ Ta có: \(n_{Mg}=\dfrac{4.8}{24}=0.2\left(mol\right)\)
PTHH:
\(2Mg+O_2\underrightarrow{t^o}2MgO\)
2 1
0.2 x
\(=>x=\dfrac{0.2\cdot1}{2}=0.1=n_{O_2}\)
\(=>V_{O_2\left(đktc\right)}=0.1\cdot22.4=2.24\left(l\right)\)
b/ \(2Mg+O_2\underrightarrow{t^o}2MgO\)
2 2
0.2 y
\(=>y=\left(0.2\cdot2\right):2=0.2=n_{MgO}\)
\(=>m_{MgO}=0.2\cdot\left(24+16\right)=8\left(g\right)\)

a) PTHH: \(Na_2SO_3+H_2SO_4\rightarrow Na_2SO_4+H_2O+SO_2\uparrow\)
Ta có: \(n_{Na_2SO_3}=\dfrac{12,6}{126}=0,1\left(mol\right)=n_{SO_2}\) \(\Rightarrow V_{SO_2}=0,1\cdot22,4=2,24\left(l\right)\)
b) Ta có: \(\left\{{}\begin{matrix}n_{SO_2}=0,1\left(mol\right)\\n_{Ca\left(OH\right)_2}=1,4\cdot0,1=0,14\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\) Tạo muối trung hòa
PTHH: \(Ca\left(OH\right)_2+SO_2\rightarrow CaSO_3\downarrow+H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{CaSO_3}=0,1\left(mol\right)=n_{Ns_2SO_4}\\n_{Ca\left(OH\right)_2\left(dư\right)}=0,04\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{CaSO_3}=0,1\cdot120=12\left(g\right)\\m_{Na_2SO_4}=0,1\cdot142=14,2\left(g\right)\\m_{Ca\left(OH\right)_2\left(dư\right)}=0,04\cdot74=2,96\left(g\right)\end{matrix}\right.\)
\(n_{Na_2SO_3}=0,1\left(mol\right)\\ PTHH:Na_2SO_3+H_2SO_4\rightarrow Na_2SO_4+H_2O+SO_2\)
(mol) 0,1 0,1 0,1 0,1
\(a.V_{SO_2}=0,1.22,4=2,24\left(l\right)\)
\(b.n_{Ca\left(OH\right)_2}=0,14\left(mol\right)\)
Do \(\dfrac{n_{OH}}{n_{SO_2}}=\dfrac{0,28}{0,1}=2.8>2\rightarrow\) Tạo muối trung hòa và Ca(OH)2 dư 0,04(mol)
\(PTHH:Ca\left(OH\right)_2+SO_2\rightarrow CaSO_3+H_2O\)
(mol) 0,1 0,1 0,1 0,1
\(m_{Ca\left(OH\right)_2\left(du\right)}=0,04.74=2,96\left(g\right)\\ m_{CaSO_3}=12\left(g\right)\\ m_{H_2O}=0,1.18=1,8\left(g\right)\)
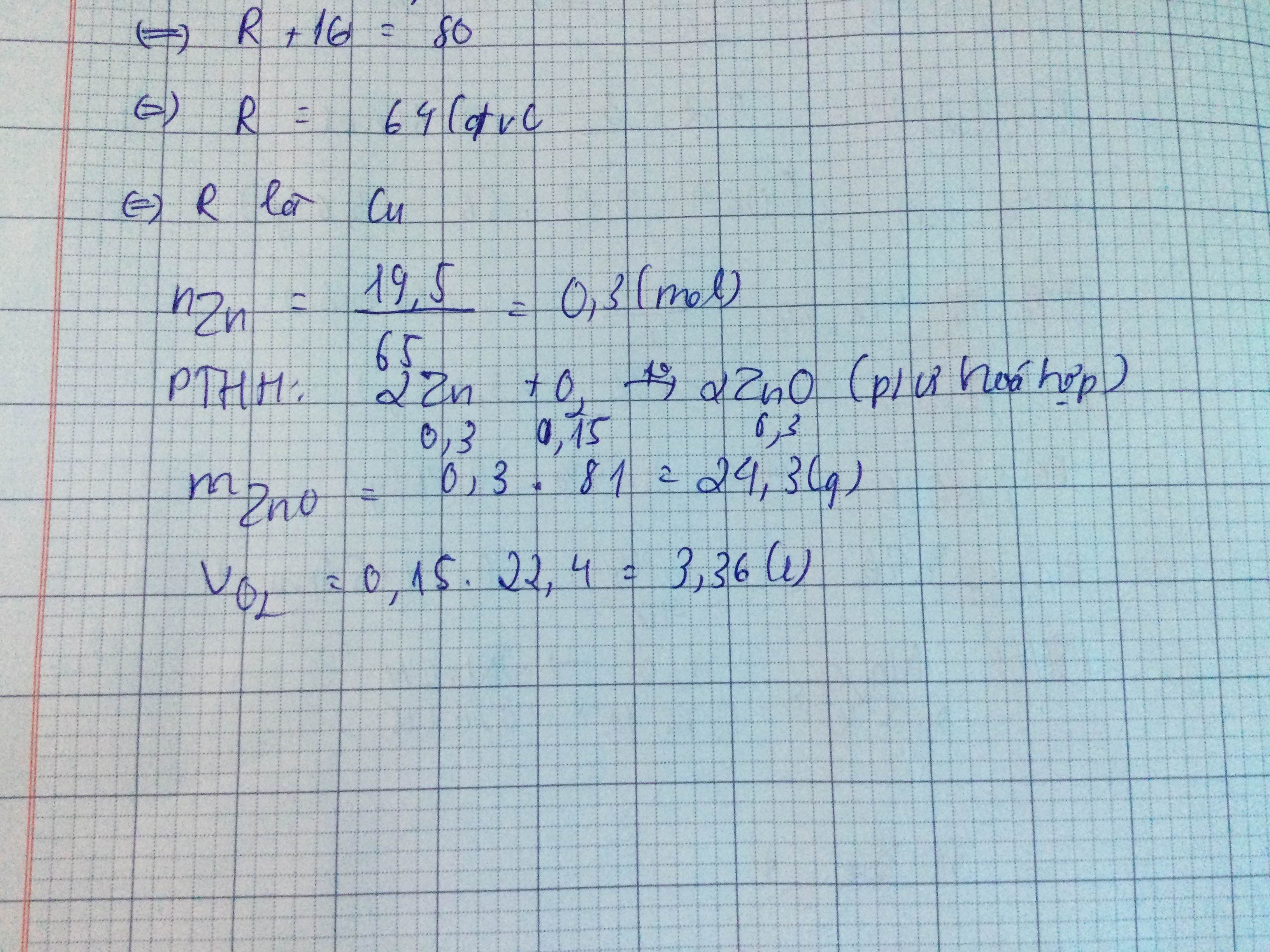
\(n_{KMnO4}=\dfrac{15,8}{158}=0,1\left(mol\right)\)
a) Pt : \(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2|\)
2 1 1 1
0,1 0,05
b) \(n_{O2}=\dfrac{0,1.1}{2}=0,05\left(mol\right)\)
\(V_{O2\left(dktc\right)}=0,05.22,4=1,12\left(l\right)\)
c) \(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
Pt : \(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4|\)
3 2 1
0,1 0,05 0,025
Lập tỉ số so sánh : \(\dfrac{0,1}{3}>\dfrac{0,05}{2}\)
⇒ Fe dư , O2 phản ứng hết
⇒ Tính toán dựa vào số mol của O2
\(n_{Fe3O4}=\dfrac{0,05.1}{2}=0,025\left(mol\right)\)
⇒ \(m_{Fe3O4}=0,025.232=5,8\left(g\right)\)
Chúc bạn học tốt
Thank bạn nha