Đốt cháy m gam Al trong x lít oxi thu được hỗn hợp rắn. Cho hỗn hợp rắn qua V lít dung dịch HCl 1M (đủ) thu được 13,35g muối và 1,68 lít H2. Các thể tích khí đo ở đktc. Tính m, x, V.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Vì B tác dụng với HCl thu được 1,68 lít khí => Trong B còn kim loại đơn chất chưa phản ứng với oxi và khí thu được là H2 , nH2 = 1,68:22,4 =0,075 mol
A + O2 → B (gồm oxit và kim loại)
Bảo toàn KL => mO2 = 14,5 - 9,7 = 4,8 gam <=> nO2 = 4,8:32 = 0,15mol
=> nO-2 trong oxit = 0,15.2 = 0,3 mol
Khi cho B tác dụng với HCl thì bản chất là H+ của HCl sẽ phản ứng với
O-2 của oxit kim loại và phản ứng kim loại đơn chất.
2H+ + O-2oxit → H2O
2H+ + Kim loại → muối + H2
=> nH+ = nHCl = 2nO-2 + 2nH2 = 0,3.2 + 0,075.2 =0,75 mol = nHCl
=> V HCl = 0,75:0,5= 1,5 lít

\(12,9g.hh\left\{{}\begin{matrix}Al:x\left(mol\right)\\Mg:y\left(mol\right)\end{matrix}\right.\underrightarrow{+Cl_2}Rắn.Y\left(37,45g\right)\underrightarrow{+HCl}H_2\left(64\%\right)\underrightarrow{+Fe_2O_3\left(50g\right)}Rắn\left(47,44g\right)\)
BTKL: \(m_X+m_{Cl_2}=m_Y\Rightarrow n_{Cl_2}=0,35\left(mol\right)\)
\(m_{Fe_2O_3}=m_{rắn}+m_{O\left(oxit\right)}\Rightarrow m_O=2,56\left(g\right)\\ \Rightarrow n_O=n_{H_2.pứ}=\dfrac{2,56}{16}=0,16\left(mol\right)\)
\(\Rightarrow n_{H_2.thoát.ra}=\dfrac{0,16}{64\%}.100\%=0,25\left(mol\right)\)
Bảo toàn mol e:
| Cho e | Nhận e |
| Mg - 2e --> \(Mg^{+2}\) | \(Cl_2^0+2e\) --> \(2Cl^-\) |
| x -> 2x | 0,35-> 0,7 |
| Al - 3e --> \(Al^{+3}\) | \(2H^++2e\) --> \(H_2\) |
| y -> 3y | 0,5<- 0,25 |
| \(N_e.cho=2x+3y\) | \(N_e.nhận=0,7+0,5=1,2\) |
\(\Rightarrow\left\{{}\begin{matrix}27x+24y=12,6\\2x+3y=1,2\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=\dfrac{3}{11}\\y=\dfrac{12}{55}\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%_{m_{Al}}=\dfrac{\dfrac{3}{11}.27.100\%}{12,6}=58,44\%\\\%_{m_{Mg}}=\dfrac{\dfrac{12}{55}.24.100\%}{12,6}=41,56\%\end{matrix}\right.\)

Đáp án D
Nhiệt phân thấy mhh X giảm 1,44g ⇒ mH2O tách từ bazo = 1,44g.
⇒ Quy hỗn hợp X gồm: mX = mKim loại + mO + mH2O.
Phản ứng với HCl: Đặt nO/X = a ta có:
2a + 2nH2 = nHCl ⇔ nO/X = 0,58 mol.
⇒ mKim loại trong X = m – mO – mH2O = m – 10,72 gam.
●Phản ứng với HNO3 có thể sinh ra muối NH4NO3:
Đặt nNH4NO3 = b ta có:
mMuối = m + 108,48 = mKim loại + mNO3–/Muối kim loại + mNH4NO3.
⇔ m + 108,48 + (m – 10,72) + (2nO + 3nNO + 8nNH4NO3)×62 + 80b.
⇔ m + 108,48 + (m – 10,72) + (0,58×2 + 0,2×3 + 8b)×62 + 80b ⇔ b = 0,0175 mol.
⇒ ∑nHNO3 đã pứ = 10nNH4NO3 + 4nNO + 2nO = 2,135 mol

Đáp án B
Chất rắn m1 là Cu. Bảo toàn e có 2nCu=3nNO
→ 2b = 2V/70
Gọi số mol: Mg là x; Cu là y; Al là z và NH4NO3 là t
Ta có hệ phương trình
(1) 2x +3y = 2n(H2) = 0,88
(2) 24x + 64y + 27z = 19,92
(3) 148x + 188y + 213z + 80t = 97,95
(4) 2x + 2y + 3t = 3n(NO) + 8n(NH4NO3) = 3V/22,4 + 8t = 6,25y + 8t
→ x = 0,08; y = 0,18; z = 0,24
→ %Mg = 9,64%

Chất rắn m1 là Cu. Bảo toàn e có 2nCu=3nNO
→ 2b = 2V/70
Gọi số mol: Mg là x; Cu là y; Al là z và NH4NO3 là t
Ta có hệ phương trình
(1) 2x +3y = 2n(H2) = 0,88
(2) 24x + 64y + 27z = 19,92
(3) 148x + 188y + 213z + 80t = 97,95
(4) 2x + 2y + 3t = 3n(NO) + 8n(NH4NO3) = 3V/22,4 + 8t = 6,25y + 8t
→ x = 0,08; y = 0,18; z = 0,24
→ %Mg = 9,64% → Đáp án B
 Cho em hỏi tại sao nhân 2 mà không phải nhân 4 ạ ?
Cho em hỏi tại sao nhân 2 mà không phải nhân 4 ạ ?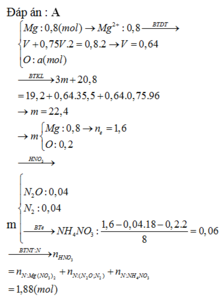



- Vì hỗn hợp rắn qua dd HCl có thấy H2 nên hh rắn chắc chắn có Al dư
\(PTHH:\left(a\right)4Al+3O_2\rightarrow\left(t^o\right)2Al_2O_3\\ \left(b\right)Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\\ \left(c\right)2Al_{dư}+6HCl\rightarrow2AlCl_3+3H_2\\ n_{H_2\left(c\right)}=\dfrac{1,68}{22,4}=0,075\left(mol\right)\\ n_{AlCl_3\left(tổng\right)}=\dfrac{13,35}{133,5}=0,1\left(mol\right)\\ n_{AlCl_3\left(c\right)}=n_{Al\left(dư\right)}=\dfrac{2}{3}.n_{H_2\left(c\right)}=\dfrac{2.0,075}{3}=0,05\left(mol\right)\\ \Rightarrow n_{AlCl_3\left(b\right)}=0,1-0,05=0,05\left(mol\right)\\ \Rightarrow n_{HCl}=\dfrac{6}{2}.n_{AlCl_3\left(tổng\right)}=\dfrac{6}{2}.0,1=0,3\left(mol\right)\\ \Rightarrow V=V_{ddHCl}=\dfrac{0,3}{1}=0,3\left(l\right)\\ n_{Al_2O_3}=\dfrac{n_{AlCl_3\left(b\right)}}{2}=\dfrac{0,05}{2}=0,025\left(mol\right)\)
\(\Rightarrow n_{Al\left(a\right)}=2.n_{Al_2O_3}=2.0,025=0,05\left(mol\right)\\ \Rightarrow n_{Al\left(tổng\right)}=n_{Al\left(a\right)}+n_{Al\left(c\right)}=0,05+0,05=0,1\left(mol\right)\\ \Rightarrow m=m_{Al\left(tổng\right)}=0,1.27=2,7\left(g\right)\\ n_{O_2}=\dfrac{3}{2}.n_{Al_2O_3}=\dfrac{3}{2}.0,025=0,0375\left(mol\right)\\ \Rightarrow V=V_{O_2\left(đktc\right)}=0,0375.22,4=0,84\left(l\right)\)