Bài 6: Ngâm một thanh kim loại có khối lượng là 50 gam trong dung dịch HCl. Sau phản ứng thu được 336 ml khí H2 (đktc) và khối lượng thanh kim loại giảm 1,68% so với ban đầu.
a. Xác định tên kim loại.
b. Tính nồng độ phần trăm của muối trong dung dịch sau phản ứng

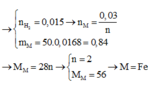
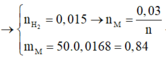
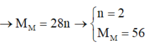



a) \(n_{H_2}=\dfrac{0,336}{22,4}=0,015\left(mol\right)\)
Gọi kim loại cần tìm là A, có hoá trị x (x:nguyên, dương)
\(2A+2xHCl\rightarrow2ACl_x+xH_2\uparrow\\ m_{giảm}=m_{kim.loại}=1,68\%.50=0,84\left(g\right)\\ n_A=\dfrac{0,015.2}{x}=\dfrac{0,03}{x}\left(mol\right)\\ \Rightarrow M_A=\dfrac{0,84}{\dfrac{0,03}{x}}=28x\left(\dfrac{g}{mol}\right)\)
Xét: x=1;x=2;x=3;x=8/3 => Nhận x=2 khi đó MA=56(g/mol)
=> A là Sắt (Fe=56)
b) Không tính được nồng độ dd muối vì không có khối lượng dung dịch HCl
a) Gọi kim loại cần tìm là M
mM(pư) = 50.1,68 / 100 = 0,84(g)
nH2= 0,336 : 22,4 = 0,015(mol)
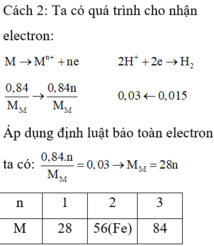
PTHH: 2M + 2xHCl --> 2MClx + xH2
0,03x <--------------------0,015
=> MM = 0,840,03x=28x(g/mol)
Xét x = 1 => L
Xét x = 2 => MM = 56(Fe)