Cho 69,6 gam MnO2 tác dụng với dd HCl đặc, dư. Dẫn khí thoát ra đi vào 500ml dd KOH 4M (ở nhiệt độ thường). Xác định nồng độ mol các chất trong dung dịch sau phản ứng (thể tích dd thay đổi không đáng kể).
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


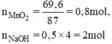
a) Phương trình hóa học của phản ứng:
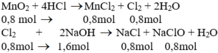
b) Theo pt (1): nCl2 = nMnCl2 = nMnO2 = 0,8 mol
Theo pt (2): nNaCl = nNaClO = nCl2 = 0,8 mol
nNaOH pư = 2. nCl2 = 2. 0,8 = 1,6 mol
⇒ nNaOH dư = 2 - 1,6 = 0,4 mol
Nồng độ mol/l của các chất trong dung dịch sau phản ứng:
CM (NaCl) = CM (NaClO) = CM(MnCl2) = 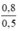 = 1,6 mol/ lit
= 1,6 mol/ lit
CM (NaOH)dư = 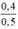 = 0,8 mol/ lit
= 0,8 mol/ lit

Đáp án C
![]() = 0,8 mol
= 0,8 mol
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
0,8 → ![]() = 0,72 (mol)
= 0,72 (mol)
Vkhí = 0,72.22,4 = 16,128 (lit)
nNaOH = 2 (mol)
Cl2 + 2NaOH → NaCl + NaClO + H2O
0,72 2 → 0,72 0,72 (mol)
do NaOH dư, tính theo Cl2
Dung dịch sau phản ứng: nNaCl = nNaClO = 0,72 (mol)
nNaOH dư = 0,56 (mol)
CNaCl = CNaClO = 1,44M, CNaOH = 1,12M

nNaOH = 0,5 x 4 = 2 mol
a) Phương trình hóa học của phản ứng :
MnO2 + 4 HCl → MnCl2 + Cl2 +2H2O
0,8 mol 0,8mol 0,8 mol
Cl2 + 2NaOH → NaCl + NaClO + H2O
0,8 mol → 1,6 mol 0,8mol 0,8mol
b) Nồng độ mol/l của các chất trong dung dịch sau phản ứng:
CM(NaCl) = = CM(NaClO) =
= 1,6 mol/l
CM(NaOH)dư = = 0,8 mol/l

nNaOH = 0,5 x 4 = 2 mol
a) Phương trình hóa học của phản ứng :
MnO2 + 4 HCl → MnCl2 + Cl2 +2H2O
0,8 mol 0,8mol 0,8 mol
Cl2 + 2NaOH → NaCl + NaClO + H2O
0,8 mol → 1,6 mol 0,8mol 0,8mol
b) Nồng độ mol/l của các chất trong dung dịch sau phản ứng:
CM(NaCl) = = CM(NaClO) =
= 1,6 mol/l
CM(NaOH)dư = = 0,8 mol/l
500 ml = 0,5l
\(n_{NaOH}=0,5.4=2\left(mol\right)\)
\(n_{MnO_2}=\frac{69,6}{87}=0,8\left(mol\right)\)
a, \(MnO_2+4HCl->MnCl_2+Cl_2+2H_2O\) (1)
\(Cl_2+2NaOH->NaCl+NaClO+H_2O\) (2)
theo (1) \(n_{Cl_2}=n_{MnO_2}=0,8\left(mol\right)\)
vì \(\frac{0,8}{1}< \frac{2}{2}\) => NaOH dư
theo (2) \(n_{NaOH\left(pư\right)}=2n_{Cl_2}=1,6\left(mol\right)\)
=> \(n_{NaOH\left(dư\right)}=2-1,6=0,4\left(mol\right)\)
theo (2) \(n_{NaCl}=n_{Cl_2}=0,8\left(mol\right)\)
nồng độ mol của các chất trọng dung dịch sau phản ứng là
\(C_{M\left(NaCl\right)}=\frac{0,8}{0,5}=1,6M\)
\(C_{M\left(NaOH\right)dư}=\frac{0,4}{0,5}=0,8\left(mol\right)\)

a) Phương trình hóa học của phản ứng:
b) Theo pt (1): nCl2 = nMnCl2 = nMnO2 = 0,8 mol
Theo pt (2): nNaCl = nNaClO = nCl2 = 0,8 mol
nNaOH pư = 2. nCl2 = 2. 0,8 = 1,6 mol
⇒ nNaOH dư = 2 - 1,6 = 0,4 mol
Nồng độ mol/l của các chất trong dung dịch sau phản ứng:
CM (NaCl) = CM (NaClO) = CM(MnCl2) = 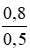
CM (NaOH)dư = 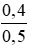
tích cho mình nha![]()

MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
nHCl = \(\dfrac{20.36,5\%}{36,5}\)= 0,2 mol => nCl2 = 0,2 : 4 = 0,05 mol
Cl2 + 2KOH →KCl + KClO + H2O
nKOH = 0,5.2 = 1 mol
=> KOH dư , Cl2 hết
nKOH dư = 1 - 0,05.2 = 0,9 mol
dung dịch A gồm KCl và KClO có số mol = nCl2 = 0,05 mol và KOH dư 0,9mol
CKCl = CKClO = \(\dfrac{0,05}{0,5}\)=0,1 M
CKOH dư = \(\dfrac{0,9}{0,5}\)= 1,8 M

\(n_{MnO_2} = \dfrac{4,35}{87} = 0,05(mol)\)
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
0,05..................................0,05..................(mol)
\(n_{NaOH} = 0,3.0,1 = 0,03(mol)\)
2NaOH + Cl2 → NaCl + NaClO + H2O
0,03........0,05.....0,015.......0,015....................(mol)
Vậy :
\(C_{M_{NaCl}} = C_{M_{NaClO}} = \dfrac{0,015}{0,3} = 0,05M\)

PTHH: \(MnO_2+4HCl\rightarrow MnCl_2+Cl_2\uparrow+2H_2O\)
\(Cl_2+2KOH\rightarrow KCl+KClO+H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{Cl_2}=n_{MnO_2}=\dfrac{69,6}{87}=0,8\left(mol\right)\\n_{KOH}=0,5\cdot4=2\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,8}{1}< \dfrac{2}{2}\) \(\Rightarrow\) KOH dư, Clo phản ứng hết
\(\Rightarrow\left\{{}\begin{matrix}n_{KCl}=n_{KClO}=0,8mol\\n_{KOH\left(dư\right)}=0,4mol\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}C_{M_{KCl}}=C_{M_{KClO}}=\dfrac{0,8}{0,5}=1,6\left(M\right)\\C_{M_{KOH\left(dư\right)}}=\dfrac{0,4}{0,5}=0,8\left(M\right)\end{matrix}\right.\)
nNaOH = 0,5 x 4 = 2 mol
a) Phương trình hóa học của phản ứng :
MnO2 + 4 HCl → MnCl2 + Cl2 +2H2O
0,8 mol 0,8mol 0,8 mol
Cl2 + 2NaOH → NaCl + NaClO + H2O
0,8 mol → 1,6 mol 0,8mol 0,8mol
b) Nồng độ mol/l của các chất trong dung dịch sau phản ứng:
CM(NaCl) = = CM(NaClO) =
= 1,6 mol/l
CM(NaOH)dư = = 0,8 mol/l

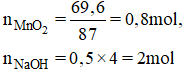
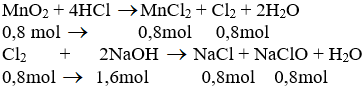
\(n_{MnO_2}=\dfrac{69,6}{87}=0,8\left(mol\right)\)
nKOH = 0,5.4 = 2(mol)
PTHH: MnO2 + 4HCl --> MnCl2 + Cl2 + 2H2O
0,8------------------------>0,8
2KOH + Cl2 --> KCl + KClO + H2O
Xét tỉ lệ \(\dfrac{2}{2}>\dfrac{0,8}{1}\) => KOH dư, Cl2 hết
2KOH + Cl2 --> KCl + KClO + H2O
1,6<--0,8---->0,8---->0,8
=> \(\left\{{}\begin{matrix}n_{KOH\left(dư\right)}=2-1,6=0,4\left(mol\right)\\n_{KCl}=0,8\left(mol\right)\\n_{KClO}=0,8\left(mol\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}C_{M\left(KOH\right)}=\dfrac{0,4}{0,5}=0,8M\\C_{M\left(KCl\right)}=\dfrac{0,8}{0,5}=1,6M\\C_{M\left(KClO\right)}=\dfrac{0,8}{0,5}=1,6M\end{matrix}\right.\)