Cho 16,4 gam hỗn hợp gồm MgO và MgCO3 phản ứng vừa đủ với dung dịch HCl 1,5 M thoát ra 2,24 lit khí CO2 (đktc). a. Viết PTHH xảy ra. b. Tính khối lượng mỗi chất trong hỗn hợp. c. Tính thể tích dung dịch HCl đã dùng.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{CO_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\\ a,PTHH:MgCO_3+H_2SO_4\rightarrow MgSO_4+H_2O+CO_2\uparrow\\ MgO+H_2SO_4\rightarrow MgSO_4+H_2O\\ \Rightarrow n_{MgCO_3}=n_{CO_2}=0,1\left(mol\right)\\ \Rightarrow m_{MgCO_3}=0,1\cdot84=8,4\left(g\right)\\ \Rightarrow\%_{MgCO_3}=\dfrac{8,4}{10,4}\cdot100\%\approx80,77\%\\ \Rightarrow\%_{MgO}=100\%-80,77\%=19,23\%\)
\(b,m_{MgO}=10,4-8,4=2\left(g\right)\\ \Rightarrow n_{MgO}=\dfrac{2}{40}=0,05\left(mol\right)\\ \Rightarrow\sum n_{H_2SO_4}=n_{MgCO_3}+n_{MgO}=0,15\left(mol\right)\\ \Rightarrow\sum m_{H_2SO_4}=0,15\cdot98=14,7\left(g\right)\\ \Rightarrow\sum m_{dd_{H_2SO_4}}=\dfrac{14,7}{9,8\%}=150\left(g\right)\\ \sum n_{MgSO_4}=\sum n_{H_2SO_4}=0,15\left(mol\right)\\ \Rightarrow\sum m_{MgSO_4}=0,15\cdot120=18\left(g\right)\\ \Rightarrow C\%_{MgSO_4}=\dfrac{18}{10,4+150-0,1\cdot44}\approx11,54\%\)

Câu 5 :
\(n_{H2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
a) Pt : \(Mg+2HCl\rightarrow MgCl_2+H_2|\)
1 2 1 1
0,1 0,2 0,1 0,1
\(MgO+2HCl\rightarrow MgCl_2+H_2O|\)
1 2 1 1
0,15 0,3 0,15
a) \(n_{Mg}=\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
\(m_{Mg}=0,1.24=2,4\left(g\right)\)
\(m_{MgO}=8,4-2,4=6\left(g\right)\)
0/0Mg = \(\dfrac{2,4.100}{8,4}=28,57\)0/0
0/0MgO = \(\dfrac{6.100}{8,4}=71,43\)0/0
b) Có : \(m_{MgO}=6\left(g\right)\)
\(n_{MgO}=\dfrac{6}{40}=0,15\left(mol\right)\)
\(n_{HCl\left(tổng\right)}=0,2+0,3=0,5\left(mol\right)\)
\(m_{HCl}=0,5.36,5=18,25\left(g\right)\)
\(m_{ddHCl}=\dfrac{18,25.100}{3,65}=500\left(g\right)\)
\(n_{MgCl2\left(tổng\right)}=0,1+0,15=0,25\left(mol\right)\)
⇒ \(m_{MgCl2}=0,15.95=14,25\left(g\right)\)
\(m_{ddspu}=8,4+500-\left(0,1.2\right)=508,2\left(g\right)\)
\(C_{MgCl2}=\dfrac{14,25.100}{508,2}=2,8\)0/0
Chúc bạn học tốt

a, Ta có : \(n_{CO2}=\dfrac{V}{22,4}=0,1\left(mol\right)\)
\(BTNT\left(C\right):n_{MgCO3}=n_{CO2}=0,1\left(mol\right)\)
\(\Rightarrow m_{MgCO3}=n.M=8,4\left(g\right)\)
\(\Rightarrow m_{MgO}=8\left(g\right)\)
b, Thấy sau khi phản ứng xảy ra thu được dung dịch A gồm \(MgSO_4\) và có thể còn \(H_2SO_4\) dư .
\(BTNT\left(Mg\right):n_{MgSO_4}=n_{MgCO3}+n_{MgO}=0,3\left(mol\right)\)
\(PTHH:MgSO_4+Ba\left(OH\right)_2\rightarrow Mg\left(OH\right)_2\downarrow+BaSO_4\downarrow\)
.................0,3............0,3..................0,3..................0,3.............
\(\Rightarrow m_{\downarrow}=m_{Mg\left(OH\right)2}+m_{BaSO4}=87,3\left(g\right)\)
Mà \(\left\{{}\begin{matrix}m\downarrow=110,6\left(g\right)>87,3g\\n_{Ba\left(OH\right)2}=C_M.V=0,45>n_{Ba\left(OH\right)2pu}\left(0,3mol\right)\end{matrix}\right.\)
=> Dung dịch A vẫn còn H2SO4 dư và mol BaSO4 được tạo ra tiếp là :
\(n_{BaSO4}=\dfrac{110,6-87,3}{M}=0,1\left(mol\right)\)
\(PTHH:H_2SO_4+Ba\left(OH\right)_2\rightarrow BaSO_4+2H_2O\)
..................0,1............0,1...............0,1........................
Lại có : \(n_{Ba\left(OH\right)2}=0,45\left(mol\right)\)
=> Trong dung dịch B còn có Ba(OH)2 dư ( dư 0,45 - 0,3 - 0,1 = 0,05mol)
\(\Rightarrow C_{MBa\left(OH\right)2}=\dfrac{n}{V}=\dfrac{0,05}{0,5}=0,1\left(M\right)\)
Vậy ...

a, PT: \(Mg+2HCl\rightarrow MgCl_2+H_2\)
\(MgO+2HCl\rightarrow MgCl_2+H_2O\)
b, Giả sử: \(\left\{{}\begin{matrix}n_{Mg}=x\left(mol\right)\\n_{MgO}=y\left(mol\right)\end{matrix}\right.\)
⇒ 24x + 40y = 4,4 (1)
Ta có: \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{Mg}=x\left(mol\right)\)
⇒ x = 0,1 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,1\left(mol\right)\\y=0,05\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{0,1.24}{4,4}.100\%\approx54,54\%\\\%m_{MgO}\approx45,46\%\end{matrix}\right.\)
c, Theo PT: \(\Sigma n_{HCl}=2n_{Mg}+2n_{MgO}=0,3\left(mol\right)\)
\(\Rightarrow V_{HCl}=\dfrac{0,3}{2}=0,15\left(l\right)=150\left(ml\right)\)
Bạn tham khảo nhé!

1)
$MgO + 2HCl to MgCl_2 + H_2O$
$Mg + 2HCl \to MgCl_2 + H_2$
2)
$n_{Mg} = n_{H_2} = \dfrac{2,24}{22,4} = 0,1(mol)$
$m_{Mg} = 0,1.24 = 2,4(gam)$
$m_{MgO} = 4,4 - 2,4 = 2(gam)$
3)
$n_{HCl} = 2n_{Mg} + 2n_{MgO} = 0,1.2 + \dfrac{2}{40}.2 = 0,3(mol)$
$V_{dd\ HCl} = \dfrac{0,3}{2} = 0,15(lít) = 150(ml)$

nH2=0,1(mol)
PTHH: Mg + 2 HCl -> MgCl2 + H2
0,1__________0,2___________0,1(mol)
MgO + 2 HCl -> MgCl2 + H2O
0,05____0,1___0,05(mol)
mMg=0,1. 24= 2,4(g) -> mMgO=4,4-2,4= 2(g) -> nMgO=0,05((mol)
b) %mMg= (2,4/4,4).100=54,545%
=> %mMgO=45,455%
c) nHCl=0,3(mol) -> mHCl=0,3.36,5=10,95(g)
=> mddHCl=(10,95.100)/7,3=150(g)

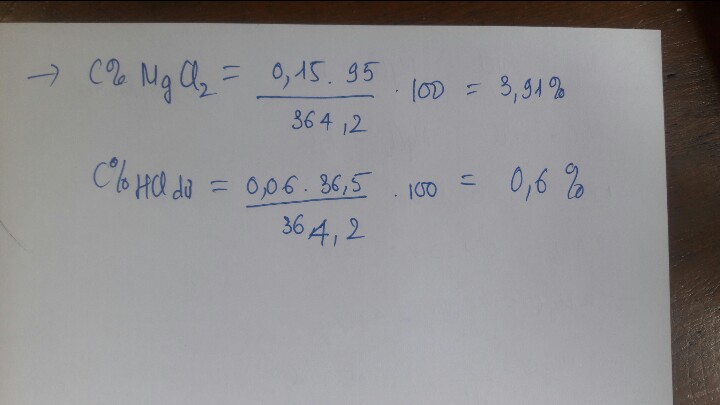
a) MgO + 2HCl ---> MgCl2 + H2O (1)
MgCO3 + 2HCl ---> MgCl2 + H2O + CO2 (2)
b) \(n_{CO_2}=\dfrac{m}{M}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
=> \(m_{MgCO_3}=n.M=0,1.84=8,4\left(g\right)\)
\(m_{MgO}=16-8,4=8\left(g\right)\)
c) \(n_{MgO}=\dfrac{m}{M}=\dfrac{8}{40}=0,2\left(mol\right)\)
=> \(n_{HCl\left(1\right)}=0,4\left(mol\right)\); nHCl(2) = 0,2(mol)
=> nHCl = 0.4 + 0,2 = 0,6 (mol)
=> VHCl = \(\dfrac{n}{C_M}=\dfrac{0,6}{1,5}=0,4\left(l\right)=400\left(ml\right)\)