Tính theo PTHH
![]() Kẽm tác dụng với axit clodric: Zn + 2HCl ZnCl2 + H2.
Kẽm tác dụng với axit clodric: Zn + 2HCl ZnCl2 + H2.
Nếu có 9,75 gam kẽm tham gia phản ứng, em hãy tính:
b/ Thể tích khí hidro thu được ở đktc?
c/ Tính khối lượng axit clohdirc cần dùng?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Zn}=\dfrac{9,75}{65}=0,15(mol)\\ Zn+2HCl\to ZnCl_2+H_2\\ \Rightarrow n_{H_2}=0,15(mol)\\ \Rightarrow V_{H_2}=0,15.22,4=3,36(l)\)
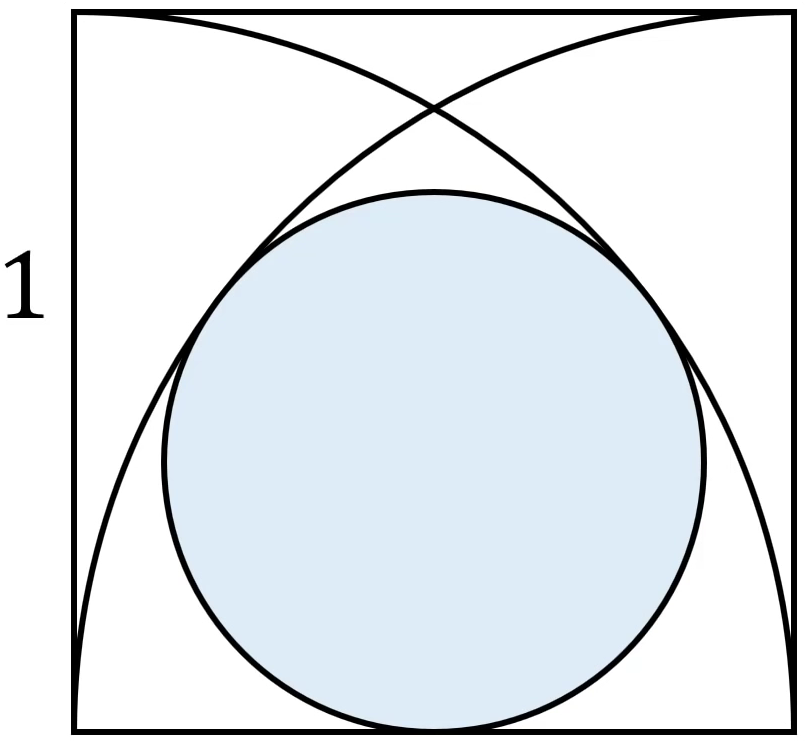
Cho hình vuông cạnh bằng 1, dựng hai phần tư đường tròn và đường tròn tiếp xúc với các phần tư, cạnh hình vuông như hình vẽ.
Tính bán kính hình tròn màu xanh
giúp mình nhé

\(n_{Zn}=\dfrac{9,75}{65}=0,15(mol)\\ Zn+2HCl\to ZnCl_2+H_2\\ \Rightarrow n_{H_2}=0,15(mol);n_{HCl}=0,3(mol)\\ a,V_{H_2}=0,15.22,4=3,36(l)\\ b,m_{HCl}=0,3.36,5=10,95(g)\)

$PTHH:Zn+2HCl\to ZnCl_2+H_2\uparrow$
$n_{Zn}=\dfrac{13}{65}=0,2(mol)$
Theo PT: $n_{ZnCl_2}=n_{H_2}=0,2(mol);n_{HCl}=0,4(mol)$
$a)m_{axit}=m_{HCl}=n.M=0,4.36,5=14,6(g)$
$b)m_{ZnCl_2}=n.M=0,2.136=27,2(g)$
$c)V_{H_2(đktc)}=n.22,4=0,2.22,4=4,48(lít)$
Số mol kẽm là :
\(n=\dfrac{m}{M}=\dfrac{13}{65}=0,2\left(mol\right)\)
PTHH : Zn + 2HCL -> ZnCl2 + H2
1 2 1 1
0,2 mol -> 0,4 mol 0,2 mol 0,2 mol
a, Khối lượng HCL là :
\(m=n.M=0,4.35,5=14,2\left(g\right)\)
b, Khối lượng ZnCL2 là :
\(m=n.M=0,1.136=13,6\left(g\right)\)
c, Thể tích H2 là : V = n . 22,4 = \(0,1.22,4=2,24\left(l\right)\)

\(n_{Zn}=\dfrac{6,5}{65}=0,1(mol)\\ Zn+2HCl\to ZnCl_2+H_2\\ \Rightarrow n_{H_2}=0,1(mol);n_{HCl}=0,2(mol)\\ a,V_{H_2}=0,1.22,4=2,24(l)\\ b,m_{HCl}=0,2.36,5=7,3(g)\)

a, PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
Ta có: \(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{Zn}=0,2\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,2.22,4=4,48\left(l\right)\)
b, Theo PT: \(n_{HCl}=2n_{Zn}=0,4\left(mol\right)\)
\(\Rightarrow m_{HCl}=0,4.36,5=14,6\left(g\right)\)

PTHH: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
+\(n_{Zn}=\dfrac{32,5}{65}=0,5\left(mol\right)\)
+\(nH_2=n_{Zn}=0,5\left(mol\right)\)
+\(n_{HCl}=2n_{Zn}=1\left(mol\right)\)
+\(V_{H2}=0,5.22,4=11,2\left(lit\right)\)
\(m_{HCl}=1.36,5=36,5\left(gam\right)\)
\(n_{Zn}=\dfrac{m}{M}=\dfrac{32,5}{65}=0,5\left(mol\right)\)
\(Zn\) \(+\) \(2\)\(HCl\) → \(ZnCl_2\) \(+\) \(H_2\)
\(0,5\) \(mol\) → \(1\) \(mol\) → \(0,5\)\(mol\) → \(0,5\) \(mol\)
\(V_{H_2}=n.22,4=0,5.22,4=11,2\left(l\right)\)
\(m_{HCl}=n.M=1.36,5=36,4\left(g\right)\)

HD:
a, ZN+2HCL=>ZNCl2+H2
b,ta có: nZN=32.5/65=0.5(mol)
Theo phương trình ta có: nH2=nZN=0.5(mol)
=>VH2=0.5*22.4=11.2(lít)
c,Ta có: nH2=4.48/22.4=0.2(mol)
Theo phương trình ta có:nHCL=2nH2=0.4(mol)
=>mHCL=0.4*36.5=14.6(g)

a+b+c) PTHH: \(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
Ta có: \(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)=n_{ZnCl_2}=n_{H_2}\)
\(\Rightarrow\left\{{}\begin{matrix}m_{ZnCl_2}=0,1\cdot136=13,6\left(g\right)\\V_{H_2}=0,1\cdot22,4=2,24\left(l\right)\end{matrix}\right.\)
d) PTHH: \(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
Theo PTHH: \(n_{H_2}=n_{Cu}=0,1\left(mol\right)\)
\(\Rightarrow m_{Cu}=0,1\cdot64=6,4\left(g\right)\)