Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có: nCO = 0,2 (mol)
- Hỗn hợp khí sau pư gồm: CO dư và CO2.
Gọi: \(\left\{{}\begin{matrix}n_{CO\left(pư\right)}=x\left(mol\right)\\n_{CO\left(dư\right)}=y\left(mol\right)\end{matrix}\right.\) ⇒ x + y = 0,2 (1)
\(CO_{\left(pư\right)}+O_{\left(trongoxit\right)}\rightarrow CO_2\)
x________x__________x (mol)
\(\Rightarrow\dfrac{44x+28y}{x+y}=20.2\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,15\left(mol\right)\\y=0,05\left(mol\right)\end{matrix}\right.\)
⇒ nO (trong oxit) = 0,15 (mol)
⇒ nFe (trong oxit) = 8 - 0,15.16 = 5,6 (g) ⇒ nFe = 0,1 (mol)
Gọi CTHH của oxit là FexOy.
\(\Rightarrow\dfrac{x}{y}=\dfrac{0,1}{0,15}=\dfrac{2}{3}\)
Vậy: CTHH cần tìm là Fe2O3.
Gọi CTHH của oxit là $R_2O_n$
$R_2O_n + nCO \xrightarrow{t^o} 2R + nCO_2$
Hỗn hợp khí sau phản ứng gồm $CO$ dư (a mol) và $CO_2(b\ mol)$
Suy ra :
$a + b = \dfrac{4,48}{22,4} = 0,2$
$\dfrac{28a + 44b}{a + b} = 20.2$
Suy ra : a = 0,05 ; b = 0,15
Theo PTHH : $n_{oxit} = \dfrac{n_{CO_2}}{n} = \dfrac{0,15}{n}(mol)$
$\Rightarrow \dfrac{0,15}{n}.(2R + 16n) = 8$
$\Rightarrow R = \dfrac{56}{3}n$
Với n = 3 thì R = 56(Fe)
Vậy oxit là $Fe_2O_3$

Đáp án D
![]()
n O t r o n g a x i t p h ả n ứ n g = n C O p h ả n ứ n g = n C O 2 sin h r a => tổng số mol khí trước và sau phản ứng là không đổi.
Hỗn hợp khí sau khi phản ứng là CO2 và CO dư
![]()
![]()
n O t r o n g o x i t p h ả n ứ n g = 0 , 75 . 0 , 24 = 0 , 18
n F e = (10,44 - 0,18.16)/56 = 0,135 mol
Gọi công thức của oxit là F e x O y
Ta có: x:y = 0,135:0,18 = 3:4 => Công thức của oxit là Fe3O4

Đáp án D
MxOy + yCO ——> xM + yCO2
![]()
=> Tổng số mol khí trước và sau phản ứng là không đổi.
Hỗn hợp khí sau phản ứng là CO2 và CO dư
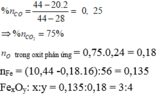
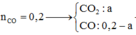
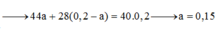
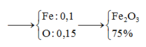





Theo gt ta có: $n_{CO}=0,1(mol)$
Bảo toàn nguyên tố C và theo tỉ khối ta có:
$n_{CO}=0,025(mol);n_{CO_2}=0,075(mol)$
Ta lại có: $n_{O/oxit}=n_{CO_2}=0,075(mol)$
Gọi CTTQ của oxit sắt đó là $Fe_xO_y$
Ta có: $M_{Fe_xO_y}=\frac{160y}{3}$
Do đó công thức của oxit sắt là $Fe_3O_4$