Hòa tan m gam Fe vào dung dịch H2SO4 loãng thu được dung dịch X Dung dịch X phản ứng vừa đủ với 200ml dung dịch KMnO4 0,1M trong môi trường H2SO4 loãng dư.Tính giá trị của m bit NTK của Fe=56
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Fe + H2SO4 → FeSO4 + H2
10FeSO4 + 2KMnO4 + 8H2SO4→ 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
nFeSO4 = 5nKMnO4 = 0,3. 0,2. 5 = 0,3 mol
=> nFe = 0,3 mol <=> mFe = 0,3 .56= 16,8 gam

Đáp án B
Cách 1: Viết phản ứng, cân bằng hệ số và tính toán theo yêu cầu:
Các phản ứng xảy ra như sau:
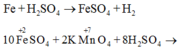
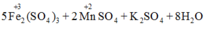
Do đó

Cách 2: Áp dụng phương pháp bảo toàn mol electron:
Ta có: ![]() (bảo toàn nguyên tố Fe)
(bảo toàn nguyên tố Fe)


Fe + H2SO4 → FeSO4 + H2
Dung dịch X gồm FeSO4 và H2SO4 dư
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
nKMnO4 = 0,1. 0,2 =0,02 mol
Theo tỉ lệ phản ứng => nFeSO4 = 5nKMnO4 = 0,02.5 = 0,1 mol
=> nFe = nFeSO4 = 0,1 mol và mFe = 0,1.56 = 5,6 gam

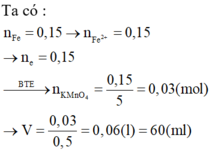


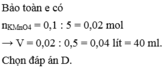
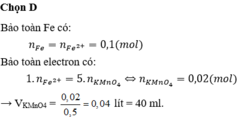
FeSO4 sao tác dụng được với KMnO4 nhỉ?