Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, PT: \(FeS+2HCl\rightarrow FeCl_2+H_2S\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(H_2S+Pb\left(NO_3\right)_2\rightarrow2HNO_3+PbS_{\downarrow}\)
b, Hỗn hợp khí thu được gồm: H2, H2S.
Ta có: \(n_{PbS}=\dfrac{23,9}{239}=0,1\left(mol\right)\)
Theo PT: \(n_{H_2S}=n_{PbS}=0,1\left(mol\right)\)
\(\Rightarrow n_{H_2}=\dfrac{2,464}{22,4}-0,1=0,01\left(mol\right)\)
⇒ Tỉ lệ số mol H2: H2S = 0,01:0,1 = 1:10
c, Theo PT: \(\left\{{}\begin{matrix}n_{FeS}=n_{H_2S}=0,1\left(mol\right)\\n_{Fe}=n_{H_2}=0,01\left(mol\right)\end{matrix}\right.\)
⇒ mhh = mFeS + mFe = 0,1.88 + 0,01.56 = 9,36 (g)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{FeS}=\dfrac{0,1.88}{9,36}.100\%\approx94,02\%\\\%m_{Fe}\approx5,98\%\end{matrix}\right.\)

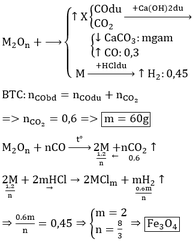
Dung dịch Ca(OH)2 không hấp thụ khí CO nên 6,72 lít khí thoát ra chính là khí CO dư.

\(n_{Mg}=\dfrac{7,2}{24}=0,3\left(mol\right);n_{O_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
\(PTHH:2Mg+O_2-^{t^o}\rightarrow2MgO\) (1)
Theo đề : 0,3........0,1
Lập tỉ lệ: \(\dfrac{0,3}{2}>\dfrac{0,1}{1}\) => Mg dư, O2 phản ứng hết
\(n_{Mg\left(pứ\right)}=2n_{O_2}=0,2\left(mol\right)\)
\(Mg_{dư}+2HCl\rightarrow MgCl_2+H_2\uparrow\)(2)
\(MgO+2HCl\rightarrow MgCl_2+H_2O\) (3)
Khí Y là H2
Theo PT (2) : \(n_{H_2}=n_{Mg\left(dư\right)}=0,3-0,2=0,1\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,1.22,4=2,24\left(l\right)\)
Dung dịch X là MgCl2
\(m_{ddsaupu}=0,1.24+0,2.40+75-0,1.2=85,2\left(g\right)\)
=>\(C\%_{MgCl_2}=\dfrac{\left(0,2+0,1\right).95}{85,2}.100=33,45\%\)

2) n Mg = \(\dfrac{7,2}{24}\) = 0,3 (mol)
n O2 = \(\dfrac{2,24}{22,4}\)= 0,1 (mol)
Mg + 1/2O2 --to> MgO
0,2 <--- 0,1 --------> 0,2
n Mg dư = 0,3 - 0,2 = 0,1 (mol)
n MgO = 0,2 (mol)
MgO + 2HCl --> MgCl2 + H2O
0,2 ------> 0,4 (mol)
Mg + 2HCl --> MgCl2 + H2
0,1 --> 0,2 ------- --------> 0,1 (mol)
V H2 = 0,1 . 22,4 = 2,24 (lít)
m Ct=\(\dfrac{100.29,2\%}{100\%}\)=92,2g
m HCl = \(\dfrac{29,2}{36,5}\) = 0,8 (mol) > 0,6 (mol) Pứ hết cho ra MgCl2
m dd = m MgO + m Mg + m HCl dd - m H2
= 0,2.40 + 0,1.24 + 100 - 0,1.2 = 110,2 (g)
\(C\%=\dfrac{0,3.95}{110,2}.100\%=25,86\%\)
2) n Mg = \(\dfrac{7,2}{24}\) = 0,3 (mol)
n O2 = \(\dfrac{2,24}{22,4}\)= 0,1 (mol)
Mg + 1/2O2 --to> MgO
0,2 <--- 0,1 --------> 0,2
n Mg dư = 0,3 - 0,2 = 0,1 (mol)
n MgO = 0,2 (mol)
MgO + 2HCl --> MgCl2 + H2O
0,2 ------> 0,4 (mol)
Mg + 2HCl --> MgCl2 + H2
0,1 --> 0,2 ------- --------> 0,1 (mol)
V H2 = 0,1 . 22,4 = 2,24 (lít)
m Ct=\(\dfrac{100.29,2\%}{100\%}\)
m HCl = \(\dfrac{29,2}{36,5}\) = 0,8 (mol) > 0,6 (mol) Pứ hết cho ra MgCl2
m dd = m MgO + m Mg + m HCl dd - m H2
= 0,2.40 + 0,1.24 + 100 - 0,1.2 = 110,2 (g)
\(C\%=\dfrac{0,3.95}{110,2}.100\%=25,86\%\)


Khí thoát ra : Metan
\(C_2H_2 + 2Br_2 \to C_2H_2Br_4\)
\(\%V_{CH_4} = \dfrac{3,36}{8,96}.100\% = 37,5\%\\ \%V_{C_2H_2} = 100\% - 37,5\% = 62,5\%\)
\(n_{C_2H_2} = \dfrac{8,96.62,5\%}{22,4} = 0,25(mol)\\ Ca_2C_2 + 2H_2O \to Ca(OH)_2 + C_2H_2\\ n_{Ca_2C_2} = n_{C_2H_2} = 0,25(mol)\\ \Rightarrow m_{đất\ đèn} = \dfrac{0,25.104}{80\%} = 32,5\ gam\)