Cho 46,8 gam hỗn hợp CuO và Fe3O4 (tỉ lệ mol 1:1) tan hết trong dung dịch H2SO4 loãng, vừa đủ, thu được dung dịch A. Cho m gam Mg vào A, sau khi phản ứng kết thúc thu được dung dịch B. Thêm dung dịch KOH dư vào B được kết tủa D. Nung D trong không khí đến khối lượng không đổi, thu được 45,0 gam chất rắn E. Giá trị gần nhất của m là
A. 8,8
B. 11,0
C. 6,6
D. 13,2


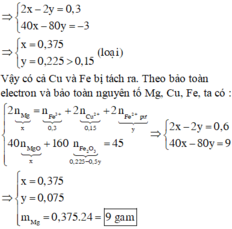





Đáp án A
Ta có số mol CuO và Fe3O4 là 0,15 mol.
Cho lượng trên tan hết trong H2SO4 thu được dung dịch A chứa CuSO4 0,15 mol, FeSO4 0,15 mol và Fe2(SO4)3 0,15 mol.
Gọi số mol của Mg là x mol.
Cho Mg vào A ta có các trường hợp sau:
+Mg chỉ tác dụng với Fe2(SO4)3 thì lúc này rắn E chứa CuO 0,15 mol, MgO x mol và Fe2O3 .
0 , 15 + 0 , 15 . 2 - 2 x 2 = 0 , 225 - x m o l → 0 , 15 . 80 + 40 x + ( 0 , 225 - x ) . 160 = 45
Giải được x>0,225 vô lý (loại).
+Mg tác dụng với CuSO4 lúc này rắn E chứa Fe2O3 0,225 mol, MgO x mol và CuO 0,3-x mol.
→ 0,225.160+40x+80(0,3-x)=45
Giải được x=0,375 >0,3 vô lý (loại).
+Mg tác dụng với FeSO4 lúc này rắn E chứa MgO x mol và Fe2O3
0 , 75 - x 2 = 0 , 375 - 0 , 5 x → 40 x + 160 ( 0 , 375 - 0 , 5 x ) = 45
Giải được x=0,375 mol → m = 9 gam.