Cho m gam NaOH vào dung dịch chứa 0,04 mol H3PO4, sau khi phản ứng hoàn toàn thu được dung dịch Y.Cô cạn Y thu được 1,22m gam chất rắn khan. Giá trị m gần nhất với
A. 6,0.
B. 8,1
C. 5,8.
D. 4,2
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
NaOH + H3PO4 -> NaH2PO4 + H2O
2NaOH + H3PO4 -> Na2HPO4 + 2H2O
3NaOH + H3PO4 -> Na3PO4 + 3H2O
Nếu chỉ có NaH2PO4 => mmuối =3m
Nếu chỉ có Na2HPO4 => mmuối = 1,775m
Nếu chỉ có Na3PO4 => mmuối = 1,37m
Ta thấy mNaOH < mmuối < mNa3PO4
=> chất rắn gồm NaOH và Na3PO4
=> nNa3PO4 = 0,04 mol=> nNaOH pứ = 0,12 mol
=> msau – mtrước = 1,22m – m = 0,04.164 – 0,12.40
=> m = 8g
=>A

Đáp án : D
NaOH + H3PO4 -> NaH2PO4 + H2O
2NaOH + H3PO4 -> Na2HPO4 + 2H2O
3NaOH + H3PO4 -> Na3PO4 + 3H2O
Nếu chỉ có NaH2PO4 => mmuối = 3m
Nếu chỉ có Na2HPO4 => mmuối = 1,775m
Nếu chỉ có Na3PO4 => mmuối = 1,37m
Ta thấy mNaOH < mmuối < mNa3PO4
=> chất rắn gồm NaOH và Na3PO4
=> nNa3PO4 = 0,04 mol=> nNaOH pứ = 0,12 mol
=> msau – mtrước = 1,22m – m = 0,04.164 – 0,12.40
=> m = 8g

Đáp án D
Gọi số mol của ancol A là: x(mol)
Gọi tổng số mol của axit cacboxylic B và este C là : y (mol)
Đốt cháy B, C luôn cho nH2O = nCO2
Đốt cháy A cho nH2O > nCO2 và có x = nH2O – nCO2
=> nH2O = x + 0,14
BTNT O: x + 2y + 0,18.2 = 0,14.2 + ( 0,14 + x)
=> y = 0,03 (mol)
nNaOH pư = n(B+C) = 0,03 (mol) => nNaOH dư = 0,02 (mol)
=> 0,03 (RCOONa) + 0,02. NaOH = 3,26 (g)
=> 0,03 ( R + 67) + 0,02. 40 = 3,26
=> R = 15
Vậy rắn Y: CH3COONa: 0,03 mol và NaOH: 0,02 (mol)
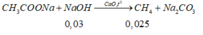
=> nCH4 = nNaOH = 0,025 (mol) => mCH4= 0,025. 16 = 0,4(g)
=> gần nhất với Đáp án D là 4,1 g
Chọn B
Trường hợp 1: OH– dư → nH2O sinh ra = 3 x 0,04 = 0,12
BTKL → m + 0,04 x 98 = 1,22m + 0,12 x 18 → m =8
→ nNaOH = 8/40 = 0,2 > 0,04 x 3 → OH– dư là hợp lý
Trường hợp 2: H+ dư → nH2O sinh ra = m/40
BTKL → m + 0,04 x 98 = 1,22m + 18 x m/40 → m = 5,85
→ nNaOH = 5,85/40 = 0,146 > 0,04 x 3 → Không thể có H+ dư.