Điện phân dung dịch chứa m gam hỗn hợp gồm CuSO4 và KCl bằng điện cực trơ, màng ngăn xốp với cường độ dòng điện không đổi I = 5A, sau thời gian t giây, thấy khối lượng catot tăng 5,12 gam. Nếu tiếp tục điện phân thêm 2t giây nữa, dừng điện phân, lấy catot ra cân lại thấy khối lượng tăng 11,52 gam; đồng thời các khí thoát ra của cả quá trình điện phân là 6,272 lít (đktc). Giá trị của m là:
A. 49,66 gam
B. 52,20 gam
C. 58,60 gam
D. 46,68 gam

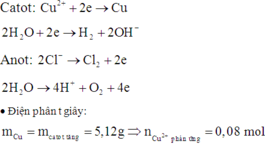
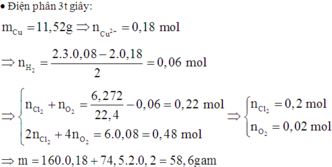

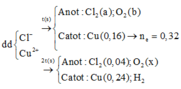
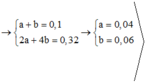

Chọn C
Do khi ta điện phân tiếp mà khối lượng catot vẫn tiếp tục tăng chứng tỏ ở t (s) thì Cu2+ chưa điện phân hết
Tại t (s):
Catot: Cu2+ + 2e → Cu
0,16 ←0,08
Tiếp tục điện phân tiếp 2t (s) nghĩa là tại 3t (s):
Catot:
Cu2+ + 2e → Cu
0,36 ←0,18
2H2O + 2e → 2OH- + H2.
Anot: 2Cl- → Cl2 + 2e
2x x 2x
2H2O → 4H+ + O2 + 4e
2y→4y → y→ 4y
Tại t = 3t (s) thì số mol e trao đổi gấp 3 lần tại t(s)
→ n(e trong quá trình tạo H2) = 0,16. 3 – 0,36 = 0,12 → n(H2) = 0,06
BT e: 2x + 4y = 0,48
Tổng số mol khí: x + y + 0,06 = 0,28
→ x = 0,2 và y = 0,02 → m = 0,18. 160 + 0,4. 74,5 = 58,6 (g)