Tính hằng số cân bằng ở 25oC của phản ứng: a) N2(k) + H2(k) NH3(k) b) N2(k) + 3H2(k) 2NH3(k) c) NH3(k) N2(k) + H2(k) Cho biết G o 298 (NH3(k)) = -16,5 kJ/mol
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án C.
N2 (k) + 3H2 (k) ⇄ t o , x t , p 2NH3 (k)
Cân bằng: 2 3 1,5 (mol)
phản ứng : 0,75 2,25 1,5
ban đầu: 2,75 5,25 0

Đáp án D
Tỉ khối hỗn hợp khí với H2 tăng => chứng tỏ số mol khí giảm ( vì khối lượng trước phản ứng và sau phản ứng không đổi) => phản ứng dịch chuyển theo chiều thuận
Các yếu tố thỏa mãn là (1) và (4)

Đáp án C
Nồng độ NH3 trong hỗn hợp lúc cân bằng sẽ lớn nhất khi: CB chuyển dịch theo chiều thuận nhiều nhất
Đây là phản ứng tỏa nhiệt, CB chuyển dịch theo chiều thuận khi giảm T
Vì tổng số mol khí lúc đầu lớn hơn tổng số mol khí lúc sau nên CB chuyển dịch theo chiều thuận khi tăng áp suất
Chọn C

Nồng độ NH3 trong hỗn hợp lúc cân bằng sẽ lớn nhất khi: cân bằng chuyển dịch theo chiều thuận nhiều nhất.
Đây là phản ứng tỏa nhiệt, cân bằng chuyển dịch theo chiều thuận khi giảm T
Vì tổng số mol khí lúc đầu lớn hơn tổng số mol khí lúc sau nên cân bằng chuyển dịch theo chiều thuận khi tăng áp suất
Chọn C

Đáp án D
Ta có:![]()
Gọi nồng độ N2 phản ứng là x(M)
Phản ứng 2NH3 (k) D N2 (k) + 3H2 (k)
Ban đầu 1 0 0
Phản ứng 2x x 3x
Cân bằng (1-2x) x 3x
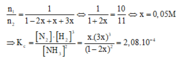
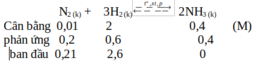
Mình nghĩ bài này đăng ở môn Hóa 10 chứ nhỉ?