Hòa tan a gam FeSO4.7H2O trong nước, được 300 ml dung dịch A. Thêm H2SO4 vào 200 ml dung dịch A, dung dịch hỗn hợp này làm mất màu 30ml dung dịch KMnO4 0,1M. Vậy a có giá trị là:
A. 62,55g
B. 65,44g
C. 63,35g
D. 55,67g
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
Bài toán này có thể giải ngắn gọn như sau:
Số mol tạo ra = số mol H+ trung hòa = 2. Số mol H2
⇒ Số mol H2 = 0,075 : 2 = 0,00375 ⇒ V = 0,84 lít

Đáp án B
● Chú ý: Tiến hành cô cạn dung dịch chứa HCl, HNO3 thì các axit này sẽ bay hơi vì chúng có nhiệt độ sôi thấp.

Đáp án D
Gọi x, y là số mol của Na2CO3 và K2SO4 trong hỗn hợp.
Phương trình phản ứng xảy ra:
Na2CO3 + 2HCl " 2NaCl + CO2 + H2O (1)
x 2x x
K2SO3 + 2HCl " 2KCl + SO2 + H2O (2)
y 2y y
2HCl + Ba(OH)2 " BaCl2 + 2H2O (3)
0,04 0,02
Theo đề bài ta có: 106x + 158y = 3,9 (I)
Mặt khác: 44 x + 16 y x + y = 33,586.16 => -13,328x + 6,672y = 0 (II)
ð x = 0,00925 mol; y = 0,0185 mol
ð %Na2CO3 = 0 , 00925 . 106 3 , 9 .100% = 25,14 à %K2SO3 = 74,86%

Đáp án D
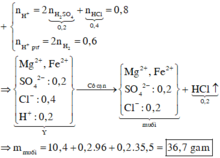
► Xử lý dữ kiện 200 ml dung dịch Y: nH+ = 0,2 × (0,2 + 0,15 × 2) = 0,1 mol.
pH = 13 ⇒ OH– dư ⇒ [OH–] = 1013 – 14 = 0,1M ⇒ nOH– dư = 0,4 × 0,1 = 0,04 mol.
||⇒ nOH–/Y = 0,04 + 0,1 = 0,14 mol ⇒ 400 ml dung dịch Y chứa 0,28 mol OH–.
► Dễ thấy nOH– = 2nH2 + 2nO/oxit ⇒ nO/oxit = (0,28 – 2 × 0,07) ÷ 2 = 0,07 mol.
||⇒ m = 0,07 × 16 ÷ 0,0875 = 12,8(g)

Đáp án A.
Hướng dẫn :
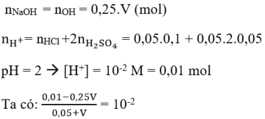
⇒ 0,01 - 0,25.V = 0,01.0,05 + 0,01 V à 0,26.V = 0,01 - 0,01.0,05
⇒ V = 0,0365 l = 36,5 ml

Đáp án A
Gọi x, y là số mol của N2 và NO trong hỗn hợp.
Ta có:
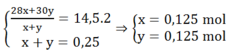


Ta có: ∑necho = ∑ne nhận
→ 0,3 + 2a = 1,25 + 0,375
→a = 0,6625 mol
Đáp án A
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
Theo phương trình:
Trong 300ml có: