Hòa tan 18,4 gam hỗn hợp X gồm Fe và Cu trong dung dịch H2SO4 đặc, nóng dư thu được 7,84 lít SO2 (đktc) và dung dịch Y. Phần trăm khối lượng của Fe trong hỗn hợp X là:
A. 60,87%.
B. 45,65%.
C. 53,26%.
D. 30,43%.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1) Đặt \(\left\{{}\begin{matrix}n_{Cu}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\end{matrix}\right.\) \(\Rightarrow64a+56b=18,4\) (1)
Ta có: \(n_{SO_2}=\dfrac{7,84}{22,4}=0,35\left(mol\right)\)
Bảo toàn electron: \(2a+3b=0,35\cdot2=0,7\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,2\\b=0,1\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}\%m_{Cu}=\dfrac{0,2\cdot64}{18,4}\cdot100\%\approx69,57\%\\\%m_{Fe}=30,43\%\end{matrix}\right.\)
2) PTHH: \(NaOH+SO_2\rightarrow NaHSO_3\)
Theo PTHH: \(n_{NaOH}=n_{SO_2}=0,35\left(mol\right)\) \(\Rightarrow V_{NaOH}=\dfrac{0,35}{2}=0,175\left(l\right)=175\left(ml\right)\)

\(1) n_{Cu} = a(mol) ; n_{Fe} = b(mol) \Rightarrow 64a + 56b = 18,4(1)\\ n_{SO_2} = \dfrac{7,84}{22,4} = 0,35(mol)\)
Bảo toàn electron :
\(2a + 3b = 0,35.2(2)\\ (1)(2) \Rightarrow a = 0,2 ; b = 0,1\\ \%m_{Cu} = \dfrac{0,2.64}{18,4}.100\% = 69,57\%\\ \%m_{Fe} = 100\%-69,57\% = 30,43\%\\ 2) NaOH + SO_2 \to NaHSO_3\\ n_{NaOH} = n_{SO_2} = 0,35(mol)\\ \Rightarrow V_{dd\ NaOH} = \dfrac{0,35}{2} = 0,175(lít)\)

Đáp án C

- Giả sử Mg, Fe đều phản ứng hết với muối kim loại => Z chứa toàn bộ số mol Mg2+ ; Fex+
=> T chứa Mg(OH)2 và Fe(OH)x => Chất rắn cuối cùng là MgO và Fe2O3 chắc chắn phải có khối lượng lớn hơn lượng kim loại ban đầu trong X => Không thỏa mãn đề bài (7,2 < 7,36)
=> Các muối nitrat phản ứng hết, kim loại dư và đó là Fe (vì Mg phản ứng trước)
=> kết tủa Y gồm Cu, Ag, Fe.
- Gọi nMg = a ; nFe(pứ) = b ; nFe dư = c => mX = 24a + 56b + 56c = 7,36 (1)
- Bảo toàn e cho phản ứng trao đổi muối: 2nMg + 2nFe pứ = nAg + 2nCu = 2a + 2b
- Khi Y + H2SO4 đặc nóng (Fe → Fe3+)
Bảo toàn electron: 2nCu + nAg + 3nFe dư = 2nSO2 = 2.5,04/22,4 = 0,45 mol
=> 2a + 2b + 3c = 0,45 (2)
- Như đã phân tích ở trên. chất rắn cuối cùng gồm MgO và Fe2O3.
Bảo toàn nguyên tố: nMg = nMgO = a ; nFe2O3 = ½ nFe pứ = 0,5b
=> mrắn = mMgO + mFe2O3 = 40a + 160.0,5b = 40a + 80b = 7,2 (3)
Từ (1,2,3) => a = 0,12 ; b = 0,03 ; c = 0,05 mol
=> mFe(X) = 56.(0,03 + 0,05) = 4,48g
=> %mFe(X) = 4,48: 7,36 = 60,87%

Quy đổi hỗn hợp X thành Fe (a mol) và O (b mol)
Các quá trình nhường và nhận electron:
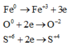
Theo định luật bảo toàn khối lượng ta có: 56a + 16b = 49,6 (1)
Theo định luật bảo toàn electron ta có: 0,4.2 + 2b = 3a (2)
(1) và (2) => a = 0,7; b = 0,65 (mol)
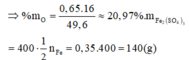
Đáp án A
Đáp án D.
Gọi nCu = y, nFe = x mol
Áp dụng định luật bảo toàn e ta có: 3x+2y = 0,7 (1)
Khối lượng hai kim loại = 1,84 g: 56x+64y = 184 (2).
Giải 1,2 ta có: x = 0,1, y = 0,2 (mol)
% m F e = 0 , 1 . 56 18 , 4 . 100 % = 30 , 43 %