Có hai lá kẽm khối lượng như nhau. Một lá cho vào dung dịch đồng(II) nitrat, lá kia cho vào dung dịch chì(II) nitrat. Sau cùng một thời gian phản ứng, khối lượng lá kẽm thứ nhất giảm 0,05 gam. Viết các phương trình hoá học.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


n Zn = x
Theo đầu bài ta có : 65x - 64x = 0,05
=> x = 0,05 (mol) ; m Zn = 0,05 x 65 = 3,25 (gam).
Zn + Pb NO 3 2 → Zn NO 3 2 + Pb↓
0,05 mol 0,05 mol
Khối lượng lá kẽm thứ 2 tăng: ( 0,05 x 207) - 3,25 = 7,1 (gam).

Giải:
a, \(Zn+Cu\left(NO_3\right)_2\rightarrow Zn\left(NO_3\right)_2+Cu\downarrow\)
\(x.................................x\)
b, Theo đầu bài ta có: \(65x-64x=0,05\)
\(\Rightarrow x=0,05\left(mol\right)\)
\(m_{Zn}=0,05.65=3,25\left(g\right)\)
\(Zn+Pb\left(NO_3\right)_2\rightarrow Zn\left(NO_2\right)_2+Pb\downarrow\)
\(0,5.............................................0,5\)
Khối lượng lá kẽm thứ 2 tăng:
\(0,05.207-3,25=7,1\left(g\right)\)

Đáp án C
Zn + Fe2+ → Zn2+ + Fe
Mol x → x
=> Dmgiảm = mZn pứ - mFe tạo ra
=> 8,5 – 7,6 = 65x – 56x => x = 0,1 mol
=> mZn pứ = 65.0,1 = 6,5g

Khối lượng kim loại tăng : 13,6 - 6 = 7,6 (gam)
Gọi n Cu = x mol
n Ag = 2x mol
Có: 2x x 108 - 64x = 7,6
=> x = 0,05 → m Cu = 0,05 x 64 = 3,2g
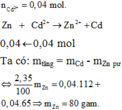

Zn + Cu NO 3 2 → Zn NO 3 2 + Cu