Dẫn hỗn hợp khí X gồm axetilen và anđehit axetic vào dung dịch AgNO3 trong ammoniac thấy tạo ra kết tủa gồm hai chất. Lấy kết tủa cho vào dung dịch axit HCl dư thấy có khí bay lên và còn một phần không tan Y. Hòa tan Y trong dung dịch HNO3 đặc thấy có khí màu nâu bay lên. Viết phương trình hóa học của các phản ứng xảy ra để giải thích quá trình thí nghiệm trên.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

C2H2 + 2AgNO3 + 2NH3 → C2Ag2 ↓ + 2NH4NO3
CH3CHO + 2AgNO3 + 3NH3 + H2O → CH3COONH4 + 2Ag ↓ + 2NH4NO3
C2Ag2 + 2HCl → 2AgCl ↓ + C2H2 ↑
Y(AgCl, Ag) + HNO3 --> ...
Ag + 2HNO3 → AgNO3 + NO2 ↑ + H2O

CH3CHO + 2AgNO3 + 3NH3 + H2O → CH3COONH4 + 2Ag↓ + 2NH4NO3 (1)
CH3COOH + NaOH → CH3COONa + H2O (2)
Theo (1):
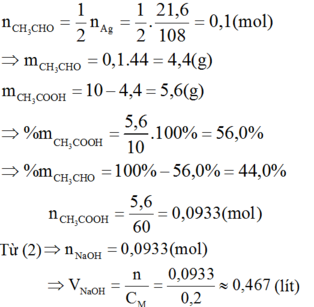

Đáp án B
nBaCO3 = 35,46: 197 = 0,18 mol
nAgCl = 17,22 : 143,5 = 0,12 mol
Bảo toàn C: => nCO2 = nBaCO3 = 0,18 mol
Bảo toàn Cl: nHCl = nAgCl = 0,12 mol
mBình tăng = mH2O + mHCl
=> nH2O = ( 6,54 – 0,12.36,5) :18 = 0,12 mol

CH3CHO + 2AgNO3 + 3NH3 + H2O → CH3COONH4 + 2Ag↓ + 2NH4NO3 (1)
CH3COOH + NaOH → CH3COONa + H2O (2)

Đáp án A
Có
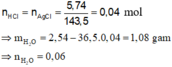
Khí thoát ra khỏi bình là CO2.
CO2 + 0,1 mol Ca(OH)2 → CaCO3 + dung dịch
Dung dịch thu được + Ba(OH)2 dư → BaCO3
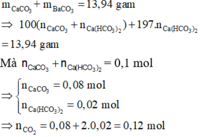
Áp dụng định luật bảo toàn khối lượng có:
mO(X) = 4,3 – 12.0,12 – 1.(2.0,06 + 0,04) – 35,5.0,04 = 1,28 gam
nO(X) = 0,08 mol
nC : nH : nO : nCl = 0,12 : 0,16 : 0,08 : 0,04 = 3:4:2:1
X có dạng C3nH4nO2nCln 107,5n < 230 n < 2,13 mà tổng số nguyên tử H và Cl phải là số chẵn n = 2
Trong phân tử X chứa 4 nguyên tử O
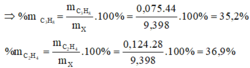
CH≡CH + 2AgNO3 + 2NH3 → AgC≡CAg↓ + 2NH4NO3
CH3CHO + 2AgNO3 + 3NH3 + H2O → CH3COONH4 + 2Ag↓ + 2NH4NO3
Lọc kết tủa: AgC≡CAg và Ag cho vào HCl chỉ có AgC≡CAg phản ứng:
AgC≡CAg + 2HCl → HC≡CH↑ + 2AgCl↓
Phần không tan Y là Ag và AgCl, hòa tan trong HNO3 đặc chỉ có Ag phản ứng:
Ag + 2HNO3 → AgNO3 + NO2nâu↑ + H2O