Cân 10,6g muối N a 2 C O 3 cho vào cốc chia độ. Rót vào cốc khoảng vài chục ml nước cất, khuấy cho muối tan hết. Sau đó rót thêm nước vào cốc cho đủ 200ml. Ta được dung dịch N a 2 C O 3 có khối lượng riêng là 1,05g/ml. Hãy tính nồng độ phần trăm và nồng độ mol của dung dịch vừa pha chế.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Nồng độ % của dung dịch Na2CO3.
Mdd = V.d = 200 x 1,05 = 210g dung dịch Na2CO3.
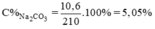
Nồng độ mol/l của dung dịch.
200ml = 0,2l.
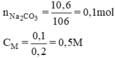

1ml dung dịch cho khối lượng 1,05 gam
200 ml dung dịch cho khối lượng m dd = 210 gam
Nồng độ phần trăm:
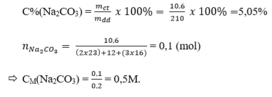

1ml dung dịch cho khối lượng 1,05 gam
200 ml dung dịch cho khối lượng mdd = 210 gam
Nồng độ phần trăm:
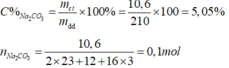
C M Na 2 CO 3 = 0 , 1 : 0 , 2 = 0 , 5 M .

Nồng độ phần trăm của dung dịch pha chế:
- Khối lượng của dung dịch \(Na_2CO_3\):
mdd = \(1,05\cdot200=210\left(g\right)\)
Nòng độ phần trăm của dung dịch:
\(C\%=\frac{100\%\cdot10,6}{210}\approx5,05\%\)
Nồng độ mol của dung dịch pha chế:
- Số mol \(Na_2CO_3\) trong dung dịch:
\(n_{Na_2CO_3}=\frac{10,6}{106}=0,1\left(mol\right)\)
- Nồng độ mol của dung dịch:
\(C_M=\frac{1000\cdot0,1}{200}=0,5\) (mol/ l)

\(nNa_2CO_3=\dfrac{10,6}{106}=0,1\left(mol\right)\)
Vdd = 200 ml = 0,2(l)
\(Na_2CO_3+H_2O\rightarrow NaHCO_3+NaOH\)
1 1 1 1 (mol)
0,1 0,1 0,1 0,1 (mol)
theo đề ta suy ra : mdd = 1,05 . 200 = 210 (g)
\(mNaHCO_3=0,1.84=8,4\left(g\right)\)
\(mNaOH=0,1.40=4\left(g\right)\)
=> ndd sau pứ = 0,1 + 0,1 = 0,2 (mol)
m dd vừa đc pha chế = m NaHCO3 + mNaOH
= > mdd vừa đc pha chế = \(8,4+4=12,4\left(g\right)\)
\(C\%dd=\dfrac{12,4.100}{210}=5,9\%\)
\(CM_{dd}=\dfrac{n_{dd}}{V_{dd}}=\dfrac{0,2}{0,2}=1M\)
Nồng độ phần trăm của dung dịch pha chế:
Nồng độ mol của dung dịch: