Hòa tan 58g muối CuSO4.5H2O vào nước được 500ml dung dịch A. Cho dần dần bột sắt vào 50ml dung dịch A, khuẩy nhẹ cho tới khi dung dịch hết màu xanh. Tính lượng sắt đã tham gia phản ứng.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(a.n_{CuSO_4}=n_{CuSO_4.5H_2O}=\dfrac{58}{250}=0,232\left(mol\right)\\ \Rightarrow CM_{CuSO_4}=\dfrac{0,232}{0,5}=0,464M\\ b.Fe+CuSO_4\rightarrow FeSO_4+Cu\\ 50mlddAcó0,0232molCuSO_4\\ n_{Fe}=n_{CuSO_4}=0,0232\left(mol\right)\\ \Rightarrow m_{Fe}=0,0232.56=1,2992\left(g\right)\)

\(n_{CuSO_4.5H_2O}=\dfrac{25}{250}=0,1\left(mol\right)\\ \Rightarrow n_{CuSO_4}=0,1\left(mol\right)\\ CuSO_4+Fe\rightarrow FeSO_4+Cu\\ n_{Fe}=n_{CuSO_4}=0,1\left(mol\right)\\ m_{Fe}=0,1.56=5,6\left(g\right)\)

a) (mol).
=> = 0,464M.
b) Fe + CuSO4 -> FeSO4 + Cu
0,232 (mol).
=> mFe = 0,232.56 = 12,992 gam.
a) (mol).
=> = 0,464M.
b) Fe + CuSO4 -> FeSO4 + Cu
0,232 (mol).
=> mFe = 0,232.56 = 12,992 gam.

a+b) PTHH: \(2Fe+3Cl_2\xrightarrow[]{t^o}2FeCl_3\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Ta có: \(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\) \(\Rightarrow\left\{{}\begin{matrix}n_{Cl_2}=0,3\left(mol\right)\\n_{HCl}=0,4\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{Cl_2}=0,3\cdot71=21,3\left(g\right)\\V_{HCl}=\dfrac{0,4}{2}=0,2\left(l\right)=200\left(ml\right)\end{matrix}\right.\)

`a)`
PTHH : `Fe + 2HCl -> FeCl_2 + H_2`
`b)`
`n_{Fe} = (11,2)/(56) = 0,2` `mol`
`n_{HCl} = 2 . n_{Fe} = 0,4` `mol`
`m_{HCl} = 0,4 . 36,5 = 14,6` `gam`
`c)`
`n_{FeCl_2} = n_{Fe} = 0,2` `mol`
`m_{FeCl_2} = 0,2 . 127 = 25,4` `gam`
`n_{H_2} = n_{Fe} = 0,2` `mol`
`V_{H_2} = 0,2 . 22,4 = 4,48` `l`

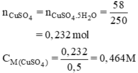
Fe + CuSO4 → FeSO4 + Cu.
nFe = nCuSO4 = 0,232 mol.
mFe = 0,232 x 56 = 12,992g.