Dẫn luồng khí H 2 dư đi qua 16 g hỗn hợp hai oxit CuO và F e 2 O 3 . nung nóng. Sau phản ứng để nguội, cân lại thấy khối lượng hỗnn hợp giảm 25%. Tính phần trăm khối lượng của mỗi oxit trong hỗn hợp ban đầu.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


$m_{O\ trong\ oxit} = m_{giảm} = 20.24\%= 4,8(gam)$
$\Rightarrow n_O = \dfrac{4,8}{16} = 0,3(mol)$
Gọi $n_{Fe_2O_3} = a(mol) ; n_{CuO} = b(mol) \Rightarrow 160a + 80b = 20(1)$
Ta có : $n_O = 3a + b = 0,3(2)$
Từ (1)(2) suy ra : a = 0,05 ; b = 0,15
$\%m_{CuO} = \dfrac{0,15.80}{20}.100\% = 60\%$

Fe2O3 + 3H2 -> 2Fe + 3H2O
CuO + H2 -> Cu + H2O
mKL=16-16.25%=12(g)
Đặt nFe2O3=a\(\Leftrightarrow\)160a
nCuO=b\(\Leftrightarrow\)80b
Ta cso hệ:
\(\left\{{}\begin{matrix}160a+80b=16\\56.2.a+64b=12\end{matrix}\right.\)
=>a=0,05;b=0,1
%mFe2O3=\(\dfrac{160.0,05}{16}.100\%=50\%\)
%mCuO=100-50%=50%

\(Fe_2O_3 + 3CO \xrightarrow{t^o} 2Fe + 3CO_2\)
Gọi \(n_{Fe_2O_3\ pư} = a(mol)\)
Theo PTHH : \(n_{Fe} = 2n_{Fe_2O_3} = 2a(mol)\)
Ta có :
\(m_{hỗn\ hợp} = m_{Al_2O_3} + 160a(gam)\)
\(m_{rắn\ sau\ phản\ ứng} = m_{Al_2O_3} + m_{Fe} = m_{Al_2O_3} + 112a(gam)\)
Ta có :
\(m_{giảm} = 160a - 112a = 36,4(100\% - 86,813\%)\)
Suy ra : a = 0,1
Vậy : \(m_{Fe} = 0,1.2.56 = 11,2(gam)\)

mhh giảm=16/100.25=4(g)
mhh giảm =mH2O
pt:
CuO+H2--->Cu+H2O
x______________x
Fe2O3+3H2--->2Fe+3H2O
y__________________3y
Hệ pt:
\(\left\{{}\begin{matrix}80x+160y=16\\18x+54y=4\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=\dfrac{7}{45}\\y=\dfrac{1}{45}\end{matrix}\right.\)
=>mCuO
=>%mCuO
=>%mFe2O3

he phuong trinh ay ban
1 cai theo % 1 cai theo g

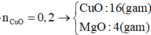
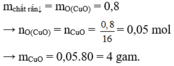
Phương trình hóa học:
Gọi x là số mol của CuO
y là số mol của F e 2 O 3 .
Ta có: 80x + 160y = 16 (1)
Khối lượng hỗn hợp giảm do oxit tạo thành kim loại:
Giải hệ phương trình ta được: