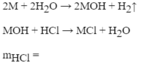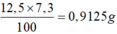Hòa tan hoàn toàn 6,85 g một kim loại kiềm thổ R bằng 50 ml dung dịch HCl 2 M. Xác định tên kim loại trên.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đề thiếu m
NaOH + HCl = NaCl + H2O
0,3 - - - - 0,3
=>số mol HCl pư là 0,1 mol
=>số mol OH- = số mol H+ = số mol HCl = 0,1 mol
=>số mol kiềm thổ là 0,05 mol
=>R = 6,85 / 0,05 = 137 => Ba

nHCl=0,1
M+2HCl\(\rightarrow\)MCl2+H2
nM=0,5nHCl=0,05
Ta có M=\(\frac{6,85}{0,05}\)=137
\(\rightarrow\)M là Bari

Đáp án A
Gọi A, B là kí hiệu của 2 kim loại. X là kí hiệu chung của 2 kim loại
Do dung dịch sau phản ứng có nồng độ mol bằng nhau nên ![]()
TH1: Nếu dung dịch chỉ chứa 2 muối
A+2HCl→ACl2+H2
a 2a a a
B+ 2HCl→BCl2+H2
a 2a a a
nHCl = 0,2 × 1,25 = 0,25
⇒ 4a = 0,25 ⇒ a = 0,0625 mol
![]() = 19,6
= 19,6
M(Be) = 9 < 19,6 < MB
19,6 = ![]() = 30,2 (loại)
= 30,2 (loại)
TH2: Vậy dung dịch sau phản ứng có HCl dư
![]()
⇒ nHCl(bđ) = 0,25 = 4a + a = 5a
⇒ a = 0,05
![]() = 24,5
= 24,5
Nếu A là Be ⇒ MA = 9
24,5 = ![]() = 40 (Ca)
= 40 (Ca)
Vậy 2 kim loại là Be và Ca

Gọi KL là M
PTHH: M+ 2HCl----->MCl2 +H2(1)
HCl+NaOH---->NaCl +H2O(2)
Ta có
n\(_{NaOH}=0,1.3=0,3\left(mol\right)\)
Theo pthh2
n\(_{HCl}=n_{NaOH}=0,3\left(mol\right)\)
Mặt khác
n\(_{HCl}=0,2.2=0,4\left(mol\right)\)
=>n\(_{HCl}pư1=0,4-0,3=0,1\left(mol\right)\)
Theo pthh1
n\(_M=\frac{1}{2}n_{HCl}=0,05\left(mol\right)\)
M\(_M=\frac{6,85}{0,05}=137\)
=> M là Bari...Kí hiệu K

Ta có: \(n_{HCl}=0,12.2=0,24\left(mol\right)\)
Gọi CTHH của oxit kim loại là A2On.
PT: \(A_2O_n+2nHCl\rightarrow2ACl_n+nH_2O\)
Theo PT: \(n_{A_2O_n}=\dfrac{1}{2n}n_{HCl}=\dfrac{0,24}{2n}=\dfrac{0,12}{n}\left(mol\right)\)
\(\Rightarrow M_{A_2O_n}=\dfrac{4,8}{\dfrac{0,12}{n}}=40n=2M_A+16n\Rightarrow M_A=12n\)
Với n = 2 thì MA = 24 (g/mol)
Vậy: A là Mg.