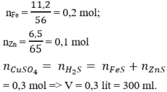Cho m gam hỗn hợp bột Fe và S có n F e = 2 n S rồi nung trong điều kiện không có oxi thu được hỗn hợp A. Hòa tan A bằng HCl dư thu được 1,6 gam chất rắn B, dung dịch C và hỗn hợp khí D. Sục D từ từ qua dung dịch C u C l 2 thấy tạo ra 9,6 gam kết tủa đen. Tính m?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.




Ta có pthh:
\(Fe+S\underrightarrow{t^o}FeS\left(1\right)\)
x1 x1 x1 (mol)
Sau khi nung trong hỗn hợp A có :
\(\left(x-x_1\right)molS\)
\(\left(2x-x_1\right)molFe\)
và x1 mol FeS
- hòa tan A trong axit HCl dư :
\(Fe+2HCl\rightarrow FeCL_2+H_2\uparrow\left(2\right)\)
\(FeS+2HCl\rightarrow FeCl_2+H_2S\uparrow\left(3\right)\)
Còn lại 0,4 g chất rắn B là lưu huỳnh dư
\(nS=x-x_1=\dfrac{0,4}{32}=0,0125\left(mol\right)\left(I\right)\)
Dung dịch C gồm HCl dư và FeCl2 với số mol là 2x .
Khí D gồm H2 và H2S .
Sục khí D từ từ vào dung dịch CuCl2 dư , chỉ có H2S phản ứng.
\(CuCl_2+H_2S\rightarrow CuS\downarrow+2HCl\left(4\right)\)
Kết tủa đen tạo thành là CuS
theo (1) (2) , (4) :
\(nCuS=x_1=\dfrac{4,8}{96}=0,05\left(mol\right)\left(II\right)\)
Kết hợp (I) ; và (II) ta có : x - x1= 0,0125
x = 0,0125 + 0,05 = 0,0625
Hiệu suất pứ tạo thành hh A:
Theo S: \(h\%=\dfrac{0,05}{0,0625}.100\%=80\%\)

a) Hỗn hợp A gồm FeS (x mol), Fe dư (y mol) và S dư (0,8 gam)
FeS + 2HCl -------> FeCl2 + H2S
x………………..………x…….x (mol)
Fe + 2HCl -------> FeCl2 + H2
y…………………..…y……..y (mol)
=> Khí D gồm H2S và H2
\(M_D=\dfrac{34x+2y}{x+y}=9.2=18\) (*)
Khí D sục rất từ từ qua dung dịch CuCl2
H2S + CuCl2 -------> CuS + 2HCl
x………………………...x (mol)
=>\(n_{CuS}=x=\dfrac{9,6}{96}=0,1\left(mol\right)\)
Từ (*) => y = 0,1 (mol)
nFe = x+ y = 0,1 + 0,1= 0,2 (mol)
=> m = 0,2 .56 = 11,2 (g)
nS pư = x = 0,1 (mol)
=> p = 0,1.32 + 0,8 = 4 (g)
b) Dung dịch C chứa FeCl2
nFeCl2 = x + y = 0,2 (mol)
FeCl2 + 2NaOH -------> Fe(OH)2 + 2NaCl
0,2................................,.0,2 (mol)
4Fe(OH)2 + O2 + 2H2O -------> 4Fe(OH)3
0,2..............................................0,2 (mol)
2Fe(OH)3 ------> Fe2O3 + 3H2O
0,2........................0,1 (mol)
Chất rắn là Fe2O3
Theo PT => nFe2O3 = 0,1 mol
=> mFe2O3 = 0,1.160 = 16 gam

Gọi x,y là số mol Fe phản ứng, Fe dư
Fe+S\(\rightarrow\)FeS
.x.....x.........x
FeS+2HCl−−−>FeCl2+H2S
.....x....................................x
Fe+2HCl−−−>FeCl2+H2
...y................................y
H2S+Pb(NO3)2−−−>PbS\(\downarrow\)+2HNO3
0,1..............................0,1........
Ta có: \(\dfrac{34x+2y}{x+y}\)=18
=> x=y=0,1
m\(_{Fe}\)bđ=m\(_{Fe}\) pứ + m\(_{Fe}\) dư =0,1.2.56=11,2(g)
m\(_S\)bđ=m\(_S\) pứ + m\(_S\) dư =0,1.32+0,8=4(g)

- Chất rắn không tan trong HCL dư là S => m S dư = 3,8g
Kết tủa đen là CuS => n CuS = 0,1 = n H 2 S = nS phản ứng
m S phản ứng = 3,2g
0,2 mol Z gồm 0,1 mol H 2 S và 0,1 mol H 2
m ban đầu = 3,8 + 3,2 = 7g
Ta lại có
n Fe p / u = n S p / u = 0,1 mol
n Fe dư = n H 2 = 0,1 mol
n Fe ban đầu → m Fe ban đầu = 0,2 .56 = 1,12 g
Vậy m = 11,2 + 0,7 = 18,2 (gam)

Đáp án B.
nFe = 0,2 mol; nZn = 0,1 mol
NaOH + H2S→NaHS + H2O
![]()

\(n_{Fe}=\dfrac{16,8}{56}=0,3mol\)
\(n_S=\dfrac{6,4}{32}=0,2mol\)
\(Fe+S\rightarrow FeS\)
0,3 0,2 0,2
Sau phản ứng Fe dư và dư 0,1mol.
\(FeS+2HCl\rightarrow FeCl_2+H_2S\uparrow\)
0,2 0,2
\(Fe_{dư}+2HCl\rightarrow FeCl_2+H_2\uparrow\)
0,1 0,1
\(\Sigma n_{khí}=0,2+0,1=0,3mol\)
\(\Rightarrow V_{khí}=0,3\cdot22,4=6,72l\)