Khi trộn dung dịch chứa 0,0075 mol NaHCO3 với 0,01 mol Ba(OH)2 thì được m gam kết tủa . Giá trị của m là ?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Khi trộn 2 dung dịch với nhau : HCO3- + OH- --> CO32- + H2O
nHCO32- = 0,15 mol < nOH- = 0,1.2
=> nCO32- = 0,15 mol
Ba2+ + CO32- --> BaCO3↓
0,1 0,15
=> nBaCO3 = 0,1mol
=> mBaCO3 = 0,1.197 = 19,7 gam

Đáp án D
Bảo toàn điện tích với dd X ta có:
0,17. 1 = 0,02.1 + 2nBa2+
=> nBa2+ = 0,075 (mol)
Bảo toàn điện tích với dd Y ta có:
2.0,03 + 1.nHCO3- = 0,1.1
=> nHCO3- = 0,04 (mol)
Trộn dd X với Y xảy ra phản ứng:
OH- + HCO3- → CO32- + H2O
0,04 →0,04 → 0,04 (mol)
Ba2+ + CO32- → BaCO3↓
0,07 ←( 0,03+ 0,04) → 0,07 (mol)
=> m↓ = mBaCO3 = 0,07.197= 13,79 (g)

Đáp án D
Bảo toàn điện tích với dd X ta có:
0,17. 1 = 0,02.1 + 2nBa2+
=> nBa2+ = 0,075 (mol)
Bảo toàn điện tích với dd Y ta có:
2.0,03 + 1.nHCO3- = 0,1.1
=> nHCO3- = 0,04 (mol)
Trộn dd X với Y xảy ra phản ứng:
OH- + HCO3- → CO32- + H2O
0,04 →0,04 → 0,04 (mol)
Ba2+ + CO32- → BaCO3↓
0,07 ←( 0,03+ 0,04) → 0,07 (mol)
=> m↓ = mBaCO3 = 0,07.197= 13,79 (g)

A
Dung dịch X. Số mol (SO4)2- = 0,03 mol.
Từ pH = 2 ta tính được số mol H+ = 5. 10-3 mol.
Vậy số mol H+ trong dung dịch Y là : 0,01 + 5. 10-3 = 0,015 mol
Số mol của Ba2+ = 2,5.10-3 mol.
Ba2+ + SO42- ® BaSO4
Vậy khối lượng kết tủa: m = 2,5.10-3.233 = 0,5825 gam.
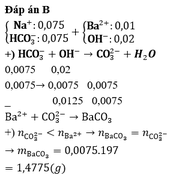
OH- + HCO3- → CO32- + H2O
Đề bài: 0,02 0,0075 (mol) ⇒ OH- dư
n CO32- =n HCO3- = 0,0075 mol
nCO32- = 0,0075 < nBa2+ = 0,01 ⇒ n↓ = 0,0075 ⇒ m↓ = 1,4775g