Thổi một luồng khí CO dư đi qua ống đựng hỗn hợp 2 oxit Fe3O4 và CuO nung nóng đến khi phản ứng xảy ra hoàn toàn thu được 2,32 gam hỗn hợp kim loại. Khí thoát ra được đưa vào bình đựng dung dịch Ca(OH)2 dư thấy có 5 gam kết tủa trắng. Tính khối lượng hỗn hợp 2 oxit kim loại ban đầu.
K
Khách
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Những câu hỏi liên quan

30 tháng 9 2019
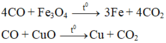
![]()
Khí thoát ra khỏi bình dẫn qua dung dịch Ca OH 2 thu được 5 gam kết tủa CaCO 3
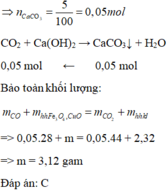

6 tháng 6 2017
Đáp án D
Vì CO dư nên hỗn hợp sau phản ứng chỉ gồm kim loại:
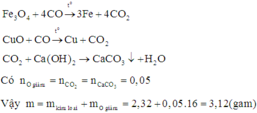

4 tháng 4 2019
Đáp án C
Kết tủa là CaCO3 0,05 mol do đó CO2 là 0,05 mol hay O bị khử 0,05 mol
![]()

HN
2 tháng 2 2021
CO2 + Ca(OH)2 → CaCO3↓ + H2O
0,34 ←0,34
CO + O(Oxit) → CO2
Nhận thấy:
nO = nCO2
mX = mO (oxit) + mY
=> mY = 37,68 – 16 . 0,34 = 32,24g


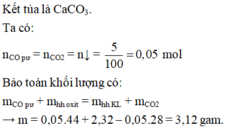
\(PTHH:\)
\(Fe_3O_4+4CO\rightarrow3Fe+4CO_2\uparrow\)
\(CuO+CO\rightarrow Cu+CO_2\uparrow\)
\(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3\downarrow+H_2O\)
Gọi số mol \(Fe_3O_4;CuO\) lần lượt là \(x;y\)
\(m_{kl}=m_{Fe}+m_{Cu}=168x+64y=2,32\left(g\right)\left(1\right)\)
\(n_{\downarrow}=n_{CaCO_3}=\frac{5}{100}=0,05\left(mol\right)\)
\(\Leftrightarrow4x+y=0,05\left(mol\right)\left(2\right)\)
Giải hệ hai phương trình \(\left(1\right);\left(2\right)\) ta được \(n_{Fe_3O_4}=n_{CuO}=0,01\left(mol\right)\)
\(\Rightarrow m_{Fe_3O_4}=0,01.232=2,32\left(g\right);m_{CuO}=0,01.80=0,8\left(g\right)\)