Đốt cháy 125g quặng pirit sắt ( chứa 96% là FeS, còn lại là tạp chất trơ ) trong oxi dư thu được sắt (III) axit và khí sunfuro. Tính thể tích khí sunfuro
Giúp mình với ạ
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Do quặng chứa 10% tạp chất
=> FeS2 chiếm 90%
\(m_{FeS_2}=\dfrac{125.90}{100}=112,5\left(g\right)\)
=> \(n_{FeS_2}=\dfrac{112,5}{120}=0,9375\left(mol\right)\)
PTHH: 4FeS2 + 11O2 --to--> 2Fe2O3 + 8SO2
0,9375---------------------->1,875
=> VSO2 = 1,875.22,4 = 42 (l)

\(m_{FeS_2}=400.\left(100-10\right)\%=360\left(g\right)\\ \rightarrow n_{FeS_2}=\dfrac{360}{120}=3\left(mol\right)\)
PTHH: 4FeS2 + 11O2 --to--> 2Fe2O3 + 8SO2
3 3
\(\rightarrow V_{SO_2}=6.22,4=134,4\left(l\right)\)
Fe2O3 oxit bazo, SO2 oxit axit

\(m_{FeS_2}=125.\left(1-4\%\right)=120\left(g\right)\)
\(n_{FeS_2}=\frac{m_{FeS_2}}{M_{FeS_2}}=\frac{120}{120}=1\left(mol\right)\)
\(PTHH:4FeS_2+11O_2\underrightarrow{t^o}2Fe_2O_3+8SO_2\)
\(Theo\) \(PTHH,\) \(ta có:\)
\(n_{SO_2}=\frac{8}{4}n_{FeS_2}=2n_{FeS_2}=2.1=2\left(mol\right)\)
\(V_{SO_2}=n_{SO_2}.22,4=2.22,4=44,8\left(l\right)\)

- Hiện tượng vật lý: nghiền nhỏ quặng pirit sắt ( F e S 2 )
- Hiện tượng hóa học:
+Quặng pirit sắt cháy tạo thành F e 2 O 3 và S O 2
+Oxi hóa S O 2 thành S O 3
+Hợp chất nước và S O 3 tạo thành axit sunfuric ( H 2 S O 4 )

Đáp án C
![]()
Vì ![]() nên chỉ có hai trường hợp là SO2 thiếu hoặc phản ứng tạo hai muối. Đề bài yêu cầu tìm giá trị lớn nhất của m nên khi cho SO2 vào dung dịch X sẽ tạo hai muối
H
S
O
-
3
và
S
O
2
-
3
nên chỉ có hai trường hợp là SO2 thiếu hoặc phản ứng tạo hai muối. Đề bài yêu cầu tìm giá trị lớn nhất của m nên khi cho SO2 vào dung dịch X sẽ tạo hai muối
H
S
O
-
3
và
S
O
2
-
3
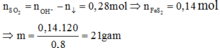

Đáp án C
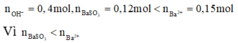
nên chỉ có hai trường hợp là SO2 thiếu hoặc phản ứng tạo hai muối. Đề bài yêu cầu tìm giá trị lớn nhất của m nên khi cho SO2 vào dung dịch


a) PTHH:
4FeS2 + 11O2 \(\rightarrow\) 2Fe2O3 + 8SO2
b)
ta có lượng FeS2 nguyên chất : mFeS2 = \(\dfrac{250.96}{100}=240\left(g\right)\)
=> nFeS2 = \(\dfrac{240}{120}=2\left(mol\right)\)
thể tích khí sunfuro thu được là :
VO2 = \(\dfrac{2.8}{4}.22,4=89,6\left(l\right)\)
c) Fe2O3 : oxit bazo
SO2 : oxit axit
a) mFeS2 sao khi loại bỏ tạp chất = 250 . (100% - 4%) = 240 (g)
=> nFeS2 = \(\frac{240}{120}=2\) mol
Pt: 4FeS2 + 11O2 --to--> 2Fe2O3 + 8SO2
.......2 mol----------------------------> 4 mol
b) VSO2 = 4 . 22,4 = 89,6 (lít)
c) Fe2O3 : oxit bazơ
.....SO2 : oxit axit
FeS2 nha
mFeS2=125.96%=120 g
nFeS2=120/120=1 mol
4FeS2+11O2->2Fe2O3+8SO2
1____________________2 mol
VSO2=2.22,4=44,8 l