: Thổi một luồng khí CO dư đi qua ống đựng hỗn hợp 2 oxit Fe3O4 và CuO nung nóng đến khi phản ứng xảy ra hoàn toàn thu được 2,32g hỗn hợp kim loại. Khí thoát ra được đưa vào bình đựng Ca(OH)2 dư thấy có 5g kết tủa trắng. Viết PTPƯ. Tính khối lượng hỗn hợp 2 oxit ban đầu.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


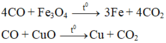
![]()
Khí thoát ra khỏi bình dẫn qua dung dịch Ca OH 2 thu được 5 gam kết tủa CaCO 3
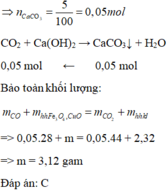

Đáp án D
Vì CO dư nên hỗn hợp sau phản ứng chỉ gồm kim loại:
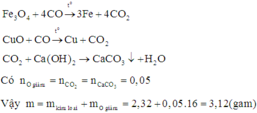

Đáp án C
Kết tủa là CaCO3 0,05 mol do đó CO2 là 0,05 mol hay O bị khử 0,05 mol
![]()

CO2 + Ca(OH)2 → CaCO3↓ + H2O
0,34 ←0,34
CO + O(Oxit) → CO2
Nhận thấy:
nO = nCO2
mX = mO (oxit) + mY
=> mY = 37,68 – 16 . 0,34 = 32,24g

\(PTHH:\)
\(Fe_3O_4+4CO\rightarrow3Fe+4CO_2\uparrow\)
\(CuO+CO\rightarrow Cu+CO_2\uparrow\)
\(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3\downarrow+H_2O\)
Gọi số mol \(Fe_3O_4;CuO\) lần lượt là \(x;y\)
\(m_{kl}=m_{Fe}+m_{Cu}=168x+64y=2,32\left(g\right)\left(1\right)\)
\(n_{\downarrow}=n_{CaCO_3}=\frac{5}{100}=0,05\left(mol\right)\)
\(\Leftrightarrow4x+y=0,05\left(mol\right)\left(2\right)\)
Giải hệ hai phương trình \(\left(1\right);\left(2\right)\) ta được \(n_{Fe_3O_4}=n_{CuO}=0,01\left(mol\right)\)
\(\Rightarrow m_{Fe_3O_4}=0,01.232=2,32\left(g\right);m_{CuO}=0,01.80=0,8\left(g\right)\)


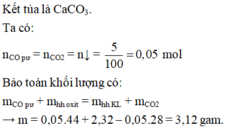
có thể giải thích tại sao số mol của CaCO3 sau phản ứng là 4x+y đc k ạ