Cho 0,672 lít khí H2 tác dụng với 0.56 lít khí Cl2 (đktc) rồi hòa tan sản phẩm vào nước để được 10gam dung dịch A. Lấy 5g dung dịch A tác dụng với AgNO3 dư thu được 1,435 gam kết tủa. Tính hiệu suất phản ứng giữa Cl2 và H2, giả sử Cl2 và H2 không tan trong nước.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{H_2}=\dfrac{1}{22,4}=\dfrac{5}{112}\left(mol\right)\)
\(n_{Cl_2}=\dfrac{0,672}{22,4}=0,03\left(mol\right)\)
PTHH: H2 + Cl2 --as--> 2HCl
Xét tỉ lệ: \(\dfrac{\dfrac{5}{112}}{1}>\dfrac{0,03}{1}\) => Hiệu suất tính theo Cl2
\(n_{AgCl}=\dfrac{7,175}{143,5}=0,05\left(mol\right)\)
Bảo toàn Cl: \(n_{Cl_2\left(pư\right)}=0,025\left(mol\right)\)
\(H\%=\dfrac{0,025}{0,03}.100\%=83,33\%\)

\(n_{AgCl}=\dfrac{7,175}{143,5}=0,05\left(mol\right)\)
PTHH: HCl + AgNO3 ---> AgCl↓ + HNO3
0,05<---------------0,05
\(\rightarrow m_{HCl}=0,05.36,5=1,825\left(g\right)\\
\rightarrow C\%_{ddA}=\dfrac{1,825}{50}.100\%=3,65\%\)
\(n_{Cl_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Đặt H = x%
PTHH: Cl2 + H2 --as--> 2HCl
LTL: 6,72 < 10 => H2 dư
=> nHCl = 0,3x (mol)
\(\rightarrow C\%_{HCl}=\dfrac{0,3x.36,5}{0,3x.36,5+385,4}.100\%=3,65\%\\ \Leftrightarrow20,23\%\)

\(n_{AgCl}=\dfrac{43.05}{143.5}=0.3\left(mol\right)\) \(\Rightarrow n_{HCl}=0.3\left(mol\right)\)
\(n_{HCl}=\dfrac{6.72}{22.4}=0.3\left(mol\right),n_{Cl_2}=\dfrac{4.48}{22.4}=0.2\left(mol\right)\)
\(H_2+Cl_2\underrightarrow{^{^{t^0}}}2HCl\)
\(0.15....0.15.......0.3\)
\(H\%=\dfrac{0.15}{0.2}\cdot100\%=75\%\)

Đáp án A
P1: nFe(OH)2 = 3,6/90 = 0,04 mol => nFe2+ = 0,04 mol
P2:
Fe2+: x mol
H+: y mol
Cl-: 2x + y
3Fe2+ + 4H+ + NO3- → 3Fe3+ + NO + 2H2O
0,06 ← 0,08 ← 0,02
=> y = 0,08
Fe2+ + Ag+ → Fe3+ + Ag
x-0,06 → x-0,06
Ag+ + Cl- → AgCl
2x+y → 2x+y
=> 108(x-0,06) + 143,5(2x+y) = 68,2 => x = 0,16
=> nFe phản ứng ban đầu = nH2 = 0,04+0,16 = 0,2 mol => VH2 = 4,48 lít
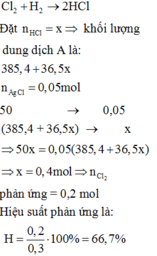



\(H_2+Cl_2\rightarrow2HCl\)
\(AgNO_3+HCl\rightarrow AgCl+HNO_3\)
\(n_{H2}=\frac{0,672}{22,4}=0,03\left(mol\right)\)
\(n_{CL2}=\frac{0,56}{22,4}=0,025\left(mol\right)\)
\(\rightarrow\) Tính theo Cl2
\(n_{AgCl}=\frac{1,435}{143,5}=0,01\left(mol\right)\)
\(\rightarrow n_{HCl_{bđ}}=0,02\left(mol\right)\)
\(\rightarrow n_{HCl_{lt}}=0,025.2=0,05\left(mol\right)\)
\(\rightarrow H=\frac{0,02}{0,05}.100=40\%\)