Nung nóng 80g KMnO4 1 tgian thấy khối lượng hỗn hợp chất rắn còn lại là 73.6gam. Hãy Tính Khối lượng mỗi chất trong hỗn hợp phản ứng
PTHH KMnO4----> K2MnO4+MnO2+O2
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{O_2}= \dfrac{20-17,12}{32} = 0,09(mol) \)
2KMnO4 \(\xrightarrow{t^o}\) K2MnO4 + MnO2 + O2
0,18................0,09.........0,09.....0,09...............(mol)
Sau phản ứng,
\(m_{KMnO_4} = 20-0,18.158 = -8,44 <0\)(Sai đề)
Ta có PTHH: 2KMnO4 -----> K2MnO4 + MnO2 + O2.
Ta có: nKMnO4= 20/158=0,1(mol)
Theo PT, ta có: nK2MnO4= 1/2 . 0,1=0,05(mol)
=> mK2MnO4= 0,05.197=9,85(g)
nMnO2=nK2MnO4=0,05(mol)
=> mMnO2=0,05.87=4,35(g)
=> Khối lượng của chất rắn sau phản ứng là: 9,85+4,35=14,2(g)
(Chúc bạn làm tốt nhé ![]() )
)

\(n_{Al}=\dfrac{1,728}{27}=0,064\left(mol\right)\)
PTHH: 4Al + 3O2 --to--> 2Al2O3
____0,064->0,048
=> mO2 = 0,048.32 = 1,536 (g)
\(m_B=\dfrac{0,894.100}{8,127}=11\left(g\right)\)
Theo ĐLBTKL: mA = mB + mO2
=> mA = 11 + 1,536 = 12,536 (g)

Đáp án C
C nóng đỏ phản ứng với O2 thu được hỗn hợp khí có M=32
Þ 2 khí là CO và CO2 với tổng số mol bằng 0,04. Dùng quy tắc đường chéo được
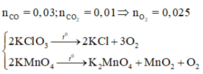
Gọi
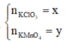
Có
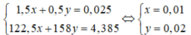
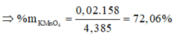

Đáp án C
C nóng đỏ phản ứng với O2 thu được hỗn hợp khí có M ¯ = 32
Þ 2 khí là CO và CO2 với tổng số mol bằng 0,04. Dùng quy tắc đường chéo được


PTHH: \(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
\(n_{KMnO_4}=\frac{39,5}{158}=0,25\left(mol\right)\)
\(n_{K_2MnO_4}=n_{MnO_2}=n_{O_2}=\frac{1}{2}.n_{KMnO_4}=\frac{1}{2}.0,25=0,125\left(mol\right)\)
a) \(m_{K_2MnO_4}=0,125.197=24,625\left(g\right)\)
\(m_{MnO_2}=0,125.87=10,875\left(g\right)\)
b) C1: \(V_{O_2}=0,125.22,4=2,8\left(l\right)\)
C2: Áp dụng ĐLBTKL:
\(m_{O_2}=39,5-m_{hhcr}=39,5-\left(24,625+10,875\right)=4\left(g\right)\)
\(n_{O_2}=\frac{4}{32}=0,125\left(mol\right)\)
\(V_{O_2}=0,125.22,4=2,8\left(l\right)\)
Ta có: \(n_{KMnO_4}=\frac{39,5}{158}=0,25\left(mol\right)\)
PTHH: 2KMnO4 -to-> K2MnO4 + MnO2 + O2
Theo PTHH và đề bài, ta có:
\(n_{K_2MnO_4}=n_{MnO_2}=n_{O_2}=\frac{0,25}{2}=0,125\left(mol\right)\)
a) Khối lượng K2MnO4:
\(m_{K_2MnO_4}=0,125.197=49,25\left(g\right)\)
Khối lượng MnO2:
\(m_{MnO_2}=87.0,125=10,875\left(g\right)\)
c) Cách 1: Tính theo số mol.
Thể tích khí O2 thu được (đktc):
\(V_{O_2\left(đktc\right)}=0,125.22,4=2,8\left(l\right)\)

a) \(2KMnO_4\underrightarrow{t^0}K_2MnO_4+MnO_2+O_2\)
b) Đặt x là số mol của \(KMnO_4\)
\(\Rightarrow n_{K_2MnO_4}=\frac{1}{2}n_{KMnO_4}=\frac{1}{2}x\)
Ta có : \(m_{KMnO_4}-m_{K_2MnO_4}=2,4\left(g\right)\)
\(\Leftrightarrow158x-\frac{197}{2}x=2,4\)
\(\Leftrightarrow x\approx0,04\left(mol\right)\)
\(\Rightarrow m_{KMnO_4}=0,04\times158=6,32\left(g\right)\)

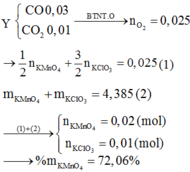
KMnO4----> K2MnO4+MnO2+O2
Áp dụng định luật bảo toàn ta có
m O2=m KMnO4-m chất rắn
=80-73,6=6,4(g)
O2=6,4/32=0,2(mol)
Theo pthh
n KMnO4=2n O2=0,4(mol)
m KMnO4=0,4.158=63,2(g)
Chất tham gia phản ứng chỉ có KMnO4 thôi nha bạn
Gọi số mol KMnO4 phản ứng là a
\(\text{ 2KMnO4-->K2MnO4+MnO2+O2}\)
a...........................0.5a...........0.5a......0.5a
Ta có :
Khối lượng giảm = khối lượng O2 bay ra
\(\text{-->80-73.6=0.5a*32-->a=0.4}\)
\(\text{->mK2MnO4=0.2*197=29.4}\)
->mMnO2=0.2*87=17.4
-->mKMnO4=73.6-29.4-17.4=26.8