Từ 300 tấn quặng pirit sắt chứa 80% FeS2 người ta sản xuất được bao nhiêu tấn H2SO4 98%, biết rằng hao hụt trong quá trình sản xuất là 10%.
A. 320 tấn B. 360 tấn
C. 400 tấn D. 420 tấn.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Cần bao nhiêu tấn quặng pirit sắt chứa 80% FeS2 để snar xuất 700 tấn dd H2SO4 70% biết rằng hao hụt trong sản xuất là 10%
---
mH2SO4= 700. 70%= 490(tấn)
PTHH: 4 FeS2 + 11 O2 -to,xt-> 2 Fe2O3 + 8 SO2
300_________________________________320(TẤN)
SO2+ 1/2 O2 -to-> SO3
320____________400(TẤN)
SO3 + H2O -> H2SO4
400_________490(TẤN)
mFeS2(LT)= 300(tấn)
-> mFeS2(TT)= (300.100)/90=1000/3 (tấn) (Do dư 10%)
=> m(quặng)= mFeS2(TT)/ 80% = 1000/3 : 80% \(\approx416,7\left(tấn\right)\)

Đáp án C.
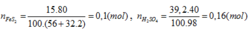
FeS2→ 2H2SO4
0,08 ← 0,16 (mol)
H% = 0,08.100/0,1= 80%

Khối lượng Fe có trong gang là mFe = 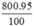 = 760 (tấn)
= 760 (tấn)
Khối lượng sắt thực tế cần để sản xuất gang (bị hao hụt 1%)
mFe = 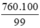 = 767,68 (tấn)
= 767,68 (tấn)
Fe3O4 + 4C → 4CO + 3Fe
232 3.56
x = ? 767,68 (tấn)
Khối lượng Fe3O4 là mFe3O4 = 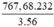 = 1060,13 (tấn)
= 1060,13 (tấn)
Khối lượng quặng manhetit là m = 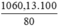 = 1325,163 (tấn)
= 1325,163 (tấn)

\(PTHH:S+O_2\underrightarrow{t^o}SO_2\\ SO_2+\frac{1}{2}O_2\xrightarrow[V_2O_5]{t^o}SO_3\\ SO_3+H_2O\rightarrow H_2SO_4\)
\(m_{S\cdot trong\cdot FeS_2}=320.10^6.45\%=144.10^6\left(g\right)\)
\(n_S=\frac{144.10^6}{32}=45.10^5\left(mol\right)\)
Theo pt: \(n_S=n_{SO_2}=n_{SO_3}=n_{H_2SO_4}\)
\(\Rightarrow n_{H_2SO_4}=45.10^5\left(mol\right)\)
\(\Rightarrow m_{H_2SO_4}=45.10^5.98=441.10^6\left(g\right)=441\left(ton\right)\)
\(H=\frac{441}{450}.100\%=98\left(\%\right)\)

Đổi 1,2 tấn = 1200 kg
Ta có: \(n_{FeS_2}=\dfrac{1200}{120}=10\left(kmol\right)\)
Bảo toàn Lưu huỳnh: \(n_{H_2SO_4\left(lý.thuyết\right)}=2n_{FeS_2}=20\left(kmol\right)\)
\(\Rightarrow m_{ddH_2SO_4\left(thực\right)}=\dfrac{20\cdot98}{50\%}\cdot80\%=3136\left(kg\right)=3,136\left(tấn\right)\)