Tính lượng nhôm nguyên chất điều chế dc từ 1 tấn quặng boxit . Biết rằng trong quặng boxit chứa 50% là nhôm oxit và kim loại luyện từ oxit đó còn chứa 2,5% tạp chất.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Lượng nhôm oxit có trong 0,5 tấn quặng là : 0,5x50/100 = 0,25 tấn = 250kg
Phương trình hoá học điều chế Al :
2 Al 2 O 3 → 4Al + 3 O 2
Khối lượng Al nguyên chất thu được từ 250 kg quặng :
x = 250x4x27/(2x102) = 132,4(kg)
Khối lượng Al lẫn tạp chất: 132,4 x 101,5% = 134,386 (kg).

Phản ứng xảy ra:
\(2Al_2O_3\underrightarrow{^{đpnc}}4Al+3O_2\)
\(m_{Al2O3}=1000.50\%=500\left(kg\right)\)
\(\Rightarrow n_{Al2O3}=\frac{500}{102}\left(mol\right)\Rightarrow n_{Al}=2n_{Al2O3}=\frac{500}{51}\left(mol\right)\)
\(\Rightarrow m_{Al}=\frac{500}{51}.27=264,7\left(kg\right)\)
\(\Rightarrow m_{\left(nhom.thu.duoc\right)}=\frac{264,7}{97,5\%}=271,5\left(kg\right)\)

chứa % tạp chất vậy đó là bao nhiêu phần trăm em ơi?

PTHH
2Al2O3 \(\rightarrow\) 4Al + 3O2
mAl2O3(ĐB) = 50% x 0,5 = 0,25(tấn)
H = mAl2O3(PƯ) : mAl2O3(ĐB) x 100% = 90%
=> mAl2O3(PƯ) : 0,25 =0,9
=> mAl2O3(PƯ) = 0,9 x 0,25 =0,225(tấn)
Theo PT : 204g Al2O3 : 108g Al
Theo ĐB : 0,225 tấn Al2O3 : x tấn Al
=> x = 0,225 x 108 : 204 = 81/680 (tấn)
mà nhôm luyện từ oxit đó có chứa 1,5% tạp chất
=> %mAl(tinh khiết) = 100% - 1,5% =98.5%
=> mAl(tinh khiết) = 98,5% x 81/680 =0,1173(tấn)
0,5 tấn=500000g
\(m_{Al_2O_3\left(khôngtinhkhiet\right)}=\frac{500000.50}{100}=250000\left(g\right)\)
\(m_{Al_2O_2\left(tinhkhiet\right)}=250000-\left(\frac{250000.1,5}{100}\right)=246250\left(g\right)\)
\(2Al_2O_3\underrightarrow{t^o}4Al+3O_2\)
\(n_{Al_2O_3}=\frac{246250}{102}=\frac{123125}{51}\left(mol\right)\)
\(n_{Al}=2.n_{Al_2O_3}=2.\left(\frac{123125}{51}\right)=\frac{246250}{51}\left(mol\right)\)
\(m_{Al\left(lt\right)}=\frac{246250}{51}.27=130367,6471\left(g\right)\)
\(m_{Al\left(thucte\right)}=\frac{130367,5471.90}{100}=117330,8824\left(g\right)=0,11733\left(tấn\right)\)

Nửa tấn=500000g
2Al2O3-->4Al+3O2
Khối lượng Al2O3 nguyên chất trong nửa tấn quặng bô-xít là
500000.50%=250000(g)
Số mol của Al2O3 là
n=m/M=250000/102
=125000/51(mol)
Số mol của Al là
nAl=2nAl2O3=2.125000/51
=250000/51(mol)
Khối lượng của Al là
m=n.M=250000/51.27
=2250000/17( g)
Khối lượng của Al nguyên chất là
2250000/17-
(2250000/17.1.5%)
=2216250/17(g)

2,7 tấn = 2700 kg
$n_{Al} = \dfrac{2700}{27} = 100(kmol)$
$\Rightarrow n_{Al_2O_3} = \dfrac{1}{2}n_{Al} = 50(kmol)$
$m_{Al_2O_3} = 50.102 = 5100(kg)$
$\Rightarrow m_{Al_2O_3\ đã\ dùng} = 5100 : 90\% = 5666,67(kg)$
$\Rightarrow m_{boxit} = 5666,67 : 80\% = 7083,3375(kg)$

2Al2O3\(\rightarrow\) 4Al + 3O2
mAl2O3= \(\frac{1000.20}{100}\)=200(kg)
Theo PTHH: mAl= 400(kg)
Vì có chứa 1,5% tạp chất
\(\rightarrow\)mAl thu được là trên lí thuyết là \(\frac{\text{400 - 400.1,5}}{100}\)=394(kg)
vì H=95% \(\Rightarrow\) mAl thực tế thu được là \(\frac{\text{394.95}}{100}\)=374,3(kg)

Lượng nhôm oxit có trong 0,5 tấn quặng là :
0,5×50100=0,25( tấn)=250(kg)0,5×50100=0,25( tấn)=250(kg)
Phương trình hoá học điều chế Al : 2Al2O3đpnc⟶criolit4Al+3O2
2 x 102 kg------------ 4 x 27 kg
250kg -------------- x kg
Khối lượng Al nguyên chất thu được từ 250 kg quặng :
x=250×4×27\2×102=132,4(kg)
Khối lượng Al lẫn tạp chất: 132,4 x 101,5% = 134,386 (kg).
vì hiệu suất là 85%
=>134,386.85\100=114,23kg
=>0,114 tấn
ý Ađúng
Trong một loại quặng boxit có 50% nhôm oxit. Nhôm luyện từ oxit đó còn chứa 1,5% tạp chất. Khi luyện 0,5 tấn quặng boxit trên với hiệu suất 85 % sẽ thu được khối lượng nhôm là
A. xấp xỉ 0,114 tấn. B. xấp xỉ 0,1323 tấn. C. xấp xỉ 0,225 tấn. D. xấp xỉ 0,228 tấn
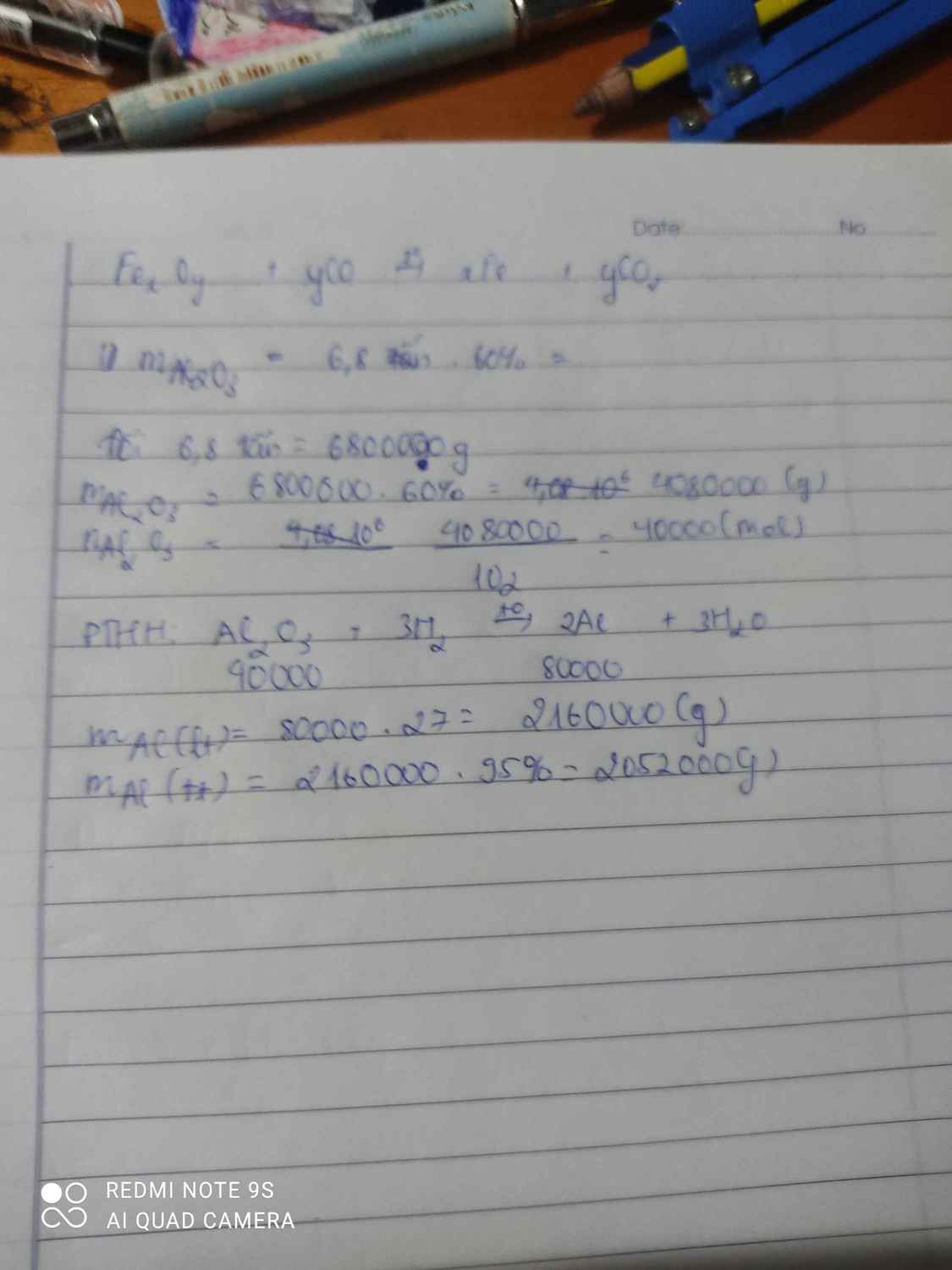
m Al2O3 = 0.5 tấn
2Al2O3 -to-> 4Al + 3O2
204_________108
0.5_________x
x =0.265
mAl thực = 0.265*(100-2.5)/100= 0.258375 tấn