cho dung dịch hcl 2m tác dụng vừa đủ với 30g hh A gồm fe feo feco3 thấy thoát ra 6,72 lít một hh khí và tạo ra 50,8g muối fecl2.
a) tính thể tích hcl đã dùng
b) tính % theo khối lượng mỗi chất trong A
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Phương trình hóa học :
Fe + 2HCl → FeCl 2 + H 2
FeO + 2HCl → FeCl 2 + H 2 O
FeCO 3 + 2HCl → FeCl 2 + H 2 O + CO 2
Tính thể tích dung dịch HCl :
n HCl = 2 n FeCl 2 = 2.31,75/127 = 0,5 mol
V HCl = 0,5/0,5 = 1l

Phương trình hóa học :
Fe + 2HCl → FeCl 2 + H 2
FeO + 2HCl → FeCl 2 + H 2 O
FeCO 3 + 2HCl → FeCl 2 + H 2 O + CO 2
Tính % khối lượng: Gọi số mol Fe, FeO, FeCO 3 trong hỗn hợp là x, y, z => x + y + z = 0,25
Theo phương trình hóa học : Số mol H 2 , CO 2 là x, z
![]()
Mặt khác : 56x + 72y + 116z = 21,6
Giải ra ta có:
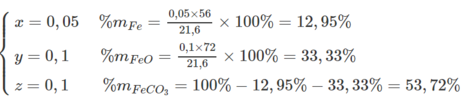

Fe+2HCl->FeCl2+H2
x---2x-----------x
Mg+2HCl->MgCl2+H2
y------2y-----------y
Ta có :
\(\left\{{}\begin{matrix}56x+24y=24\\x+y=\dfrac{13,44}{22,4}\end{matrix}\right.\)
=>x=0,3 mol, y=0,3 mol
=>%m Fe=\(\dfrac{0,3.56}{24}.100\)=70%
=>%m Mg=100-70=30%
=>VHCl=\(\dfrac{0,3.2+0,3.2}{2}\)=0,6l=600ml
b)
XCl2+2AgNO3->2AgCl+X(NO3)2
0,6--------------------1,2mol
=>m AgCl=1,2.143,5=172,2g

Mong MN giúp mình nhanh với , mình đang rất gấp
Cảm ơn mọi người nhiều nhà 😘😘
a)
Gọi $n_{Fe} = a ; n_{FeO} = b; n_{FeCO_3} = c \Rightarrow 56a + 72b + 116c = 21,6(1)$
$Fe + 2HCl \to FeCl_2 + H_2$
$FeO + 2HCl \to FeCl_2 + H_2O$
$FeCO_3 + 2HCl \to FeCl_2 + CO_2 + H_2O$
\(\dfrac{2a+44c}{a+c}=15.2=30\left(2\right)\)
$n_{FeCl_2} = a + b + c= \dfrac{31,75}{127} = 0,25(3)$
Từ (1)(2)(3) suy ra a = 0,05 ; b = 0,1 ; c = 0,1
$n_{HCl} = 2a + 2b + 2c =0,5(mol)$
$m_{dd\ HCl} = \dfrac{0,5.36,5}{7,3\%} = 250(gam)$
$\%m_{Fe} = \dfrac{0,05.56}{21,6}.100\% = 12,96\%$
$\%m_{FeO} = \dfrac{0,1.72}{21,6}.100\% = 33,33\%$
$\%m_{FeCO_3} = 53,71\%$

a)
$2Al + 6HCl \to 2AlCl_3 + 3H_2$
$MgO + 2HCl \to MgCl_2 + H_2O$
Theo PTHH : $n_{Al} = \dfrac{2}{3}n_{H_2} = 0,2(mol)$
$\%m_{Al} = \dfrac{0,2.27}{18,8}.100\% = 28,7\%$
$\%m_{MgO} = 100\% - 28,7\% =71,3\%$
b) $n_{MgO} = 0,335(mol)$
Theo PTHH : $n_{HCl} = 2n_{H_2} + 2n_{MgO} =1,27(mol)$
$V_{dd\ HCl} = \dfrac{1,27}{1,6} = 0,79375(lít)$
c)
$H_2 + O_{oxit} \to H_2O$
$\Rightarrow n_{O(oxit)} = n_{H_2} = 0,3(mol)$
$\Rightarrow n_{Fe} = \dfrac{17,4 - 0,3.16}{56} = 0,225(mol)$
Ta có :
$n_{Fe} : n_O = 0,225 : 0,3 = 3 : 4$
Vậy oxit là $Fe_3O_4$

\(Zn+2HCl->ZnCl_2+H_2\\ Mg+2HCl->MgCl_2+H_2\\ n_{Zn}=a\\ n_{Mg}=b\\ 65a+24b=11,3g\\ n_{H_2}=a+b=\dfrac{6,72}{22,4}=0,3\\ a=0,1\\ m_{Zn}=65.0,1=6,5g\)

a, \(Mg+2HCl\rightarrow MgCl_2+H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
b, Ta có: 24nMg + 56nFe = 10,4 (1)
Theo PT: \(n_{H_2}=n_{Mg}+n_{Fe}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Mg}=0,2\left(mol\right)\\n_{Fe}=0,1\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{Fe}=0,2.24=4,8\left(g\right)\\m_{Fe}=0,1.56=5,6\left(g\right)\end{matrix}\right.\)
c, Theo PT: \(n_{HCl}=2n_{H_2}=0,6\left(mol\right)\Rightarrow V_{ddHCl}=\dfrac{0,6}{0,5}=1,2\left(l\right)\)

a)
$Fe + 2HCl \to FeCl_2 + H_2$
$FeO + 2HCl \to FeCl_2 + H_2O$
b)
Theo PTHH : $n_{Fe} = n_{H_2} = \dfrac{3,36}{22,4} = 0,15(mol)$
$m_{Fe} = 0,15.56 = 8,4(gam)$
$m_{FeO} = 12 - 8,4 = 3,6(gam)$
$n_{FeO} =0,05(mol)$
Theo PTHH : $n_{HCl} = 2n_{Fe} + 2n_{FeO} = 0,4(mol)$
$V_{dd\ HCl} = \dfrac{0,4}{2} = 0,2(lít)$
c) $Fe + CuSO_4 \to FeSO_4 + Cu$
$n_{Cu} = n_{Fe} = 0,15(mol) \Rightarrow m_{chất\ rắn} = m_{FeO} + m_{Cu}$
$= 3,6 + 0,15.64 = 13,2(gam)$