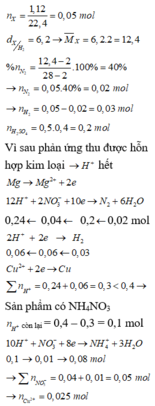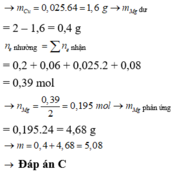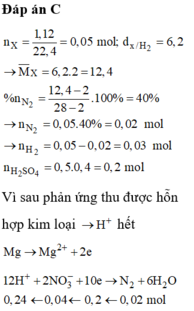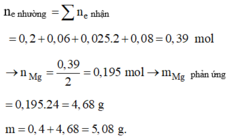X là hỗn hợp gồm Cu và kim loại M hóa trị II trong đó nCu: nM = 1:2. Hòa tan hết 9,7 gam X trong 200ml dung dịch Y chứa H2SO4 12M và HNO3 2M thu được 1,12 lít (ĐKTC) hỗn hợp Z gồm SO2 và N2. biết tỉ khối hơi của Z đối với H2 là 23
a: Tìm M
b: tính thể tích dung dịch NaOH 1,25M cần cho vào dung dịch sau phản ứng đểlượng kết tủa lớn nhất
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án : C
Xét 0,05 mol X : Áp dụng qui tắc đường chéo : nN2 = 0,02 mol ; nH2 = 0,03 mol
=> Giả sử phản ứng tạo NH4+ : x mol
=> nH+ = 12nN2 + 2nH2 + 10nNH4+
=> x = 0,01 mol
Do khí có H2 => NO3- phải hết trước H+
Sau phản ứng có hỗn hợp kim loại => Cu2+ ; H+ phản ứng hết
=> Trong dung dịch chỉ còn lại : NH4+ ; SO42- ; Mg2+
=> BT điện tích : nMg2+ = 0,195 mol
BT Nito : nNO3 = nN2.2 + nNH4+ = 0,05 mol => nCu2+ = 0,025 mol = nCu
=> mMg dư = 2 – 0,025.64 = 0,4g
=> m = mMg dư + 24. nMg pứ = mMg dư + 24nMg2+ ( dd) = 5,08g

Đáp án C
![]()
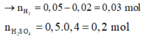
Vì sau phản ứng thu được hỗn hợp kim loại →H+ hết
Mg → Mg2+ + 2e
12H+ + 2NO−3 +10e → N2 + 6H2O
0,24 ← 0,04 ← 0,2 ← 0,02 mol
2H+ + 2e → H2
0,06 ← 0,06 ← 0,03
Cu2+ + 2e → Cu
![]()
=> Sản phẩm có NH4NO3
n H + c ò n l ạ i = 0,4 - 0,3 = 0,1 mol
10H+ + NO−3 + 8e → NH+4 + 3H2O
0,1 → 0,01 → 0,08 mol
![]()
![]()
![]()
m M g p h ả n ứ n g = 0 , 195 . 24 = 4 , 68 g
=> m = 0,4 + 4,68 = 5,08 g

Đáp án C

12H+ + 2NO−3 + 10e → N2 +6H2O
0,24 ← 0,04 ← 0,2 ← 0,02 mol
2H+ + 2e → H2
0,06 ← 0,06 ← 0,03
Cu2+ + 2e → Cu
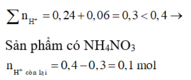
10H+ + NO−3 + 8e → NH+4 + 3H2O
0,1 → 0,01 → 0,08 mol
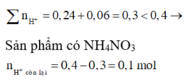
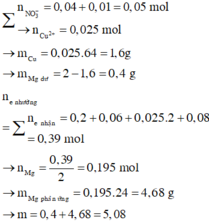

Đáp án : C
nKhí = 0,175 mol ; Mkhí = 376/7g
⇒ n N O 2 = 0 , 1 ; n S O 2 = 0 , 075 m o l
⇒ n N O 3 m u ố i = n N O 2 = 0 , 1 m o l
n S O 4 m u ố i = n S O 2 = 0 , 075 m o l
=> mmuối =32,85g

Câu 1
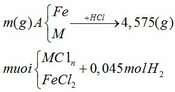
Áp dụng định luật bảo toàn nguyên
tố H ta có:
nHCl = 2nH2 = 2.0,045 = 0,09 mol
Áp dụng định luật bảo toàn khối lượng
ta có: mA + mHCl = m muối + mH2
=> m = m muối + mH2 – mA = 4,575 + 0,045.2 – 0,09.36,5 = 1,38 (gam)
Câu 2
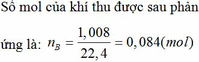
Do cho kim loại phản ứng với H2SO4 đặc và HNO3 đặc nên khí sinh ra là SO2 và NO2.
Áp dụng phương pháp đường chéo ta có:
SO2: 64 4,5
50,5
NO2: 46 13,5
→nSO2=nNO2=4,513,5=13
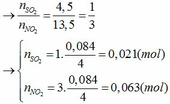
Đặt số mol của Fe và M lần lượt là x và y (mol)
- Khi cho hỗn hợp tác dụng với HCl:
Fe + 2HCl → FeCl2 + H2
x x (mol)
M + nHCl → MCln + 0,5nH2
y 0,5ny (mol)
nH2 = 0,045 => x + 0,5ny = 0,045 (1)
- Khi cho hỗn hợp tác dụng với HNO3 đặc và H2SO4 đặc:
Ta có các bán phản ứng oxi hóa – khử:
Fe → Fe3+ + 3e
x 3x
M → Mn+ + ne
y ny
S+6 + 2e → S+4 (SO2)
0,021 0,042
N+5 + 1e → N+4 (NO2)
0,063 0,063
Áp dụng định luật bảo toàn electron ta có: 3x + ny = 0,042 + 0,063 hay 3x + ny = 0,105 (2)
Từ (1) và (2) ta có hệ phương trình sau:
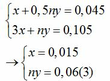
Mặt khác: mA = mFe + mM => 1,38 = 0,015.56 + My => My = 0,54(4)
Từ (3) và (4) suy ra M = 9n
Ta có bảng sau:
| n |
1 |
2 |
3 |
| M |
9 (loại) |
18 (loại) |
27 (nhận) |
Vậy kim loại M là nhôm, kí hiệu là Al.