Hỗn hợp X gồm Zn, Fe, Cu. Cho 9,25g hỗn hợp X tác dụng với dung dịch HCl dư thu được 2,24l khí H2 ở đktc. Mặt khác biết 0,3 mol hỗn hợp X phản ứng với vừa đủ với 7,84l khí Cl2 ở đktc. Tính khối lượng mỗi kim loại trong hỗn hợp X???
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án C
Đặt số mol mỗi kim loại trong 18,5 gam hỗn hợp lần lượt là a, b, c.
Ta có: mhh X =65a + 56b + 64c; n H 2 = a + b = 3 , 92 22 , 4 = 0 , 175 mol
Có số phân tử Cl2 phản ứng trung bình với hỗn hợp X:
n Cl 2 n X = 0 , 175 0 , 15 = 7 6 = ( a + 1 , 5 b + c ) ( a + b + c )
Từ đó ta có a - 2b + c = 0.
Tóm lại ta sẽ có a = b = c = 0,1 mol.
Vậy trong 18,5g hỗn họp X sẽ có 0,1 mol Fe
Chú ý:
Dung dịch axit như dung dịch HCl, HBr, HI hoặc dung dịch H2SO4 có khả năng phản ứng với các kim loại đứng trước H trong dãy điện hóa, tức là trong bài này phản ứng với Zn và Fe tạo ra ZnCl2 và FeCl2.
- Clo có khả năng phản ứng với hầu hết các kim loại (trừ Au, Pt) thậm chí còn có khả năng phản ứng với Ag ở điều kiên thích hợp và đưa kim loại lên số oxi hóa cao nhất vì vậy sản phẩm là ZnCl2,CuCl2,FeCl3

a)
TN1: Gọi (nZn; nFe; nCu) = (a; b; c)
=> 65a + 56b + 64c = 18,5 (1)
\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: Zn + 2HCl --> ZnCl2 + H2
a---------------------->a
Fe + 2HCl --> FeCl2 + H2
b----------------------->b
=> a + b = 0,2 (2)
TN2: Gọi (nZn; nFe; nCu) = (ak; bk; ck)
=> ak + bk + ck = 0,15 (3)
PTHH: Zn + Cl2 --to--> ZnCl2
ak-->ak
2Fe + 3Cl2 --to--> 2FeCl3
bk--->1,5bk
Cu + Cl2 --to--> CuCl2
ck-->ck
=> \(ak+1,5bk+ck=\dfrac{3,92}{22,4}=0,175\)(4)
(1)(2)(3)(4) => \(\left\{{}\begin{matrix}a=0,1\left(mol\right)\\b=0,1\left(mol\right)\\c=0,1\left(mol\right)\\k=0,5\end{matrix}\right.\)
\(\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{0,1.65}{18,5}.100\%=35,135\%\\\%m_{Fe}=\dfrac{0,1.56}{18,5}.100\%=30,27\%\\\%m_{Cu}=\dfrac{0,1.64}{18,5}.100\%=34,595\%\end{matrix}\right.\)
b) nO(oxit) = \(\dfrac{23,7-18,5}{16}=0,325\left(mol\right)\)
=> nH2O = 0,325 (mol)
=> nHCl = 0,65 (mol)
=> \(V=\dfrac{0,65}{1}=0,65\left(l\right)=650\left(ml\right)\)

Đáp án : D
Gọi số mol Al ; Zn ; Fe lần lượt là x ; y ; z
=> 27x + 65y + 56z = 20,4 (1)
Và 1,5x + y + z = nH2 = 0,45 (2)
Xét 0,2 mol X có lượng chất gấp t lần 20,4g X
=> t(x + y +z) = 0,2 mol (3)
Lại có : Bảo toàn e : 2nCl2 = (3x + 2y + 3z)t = 0,55 (4)
Từ (1),(2),(3),(4) => x = y = 0,1 ; z = 0,2
=> %mAl(X) = 13,24%

Gọi \(\left\{{}\begin{matrix}n_{Zn}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\\n_{Al}=c\left(mol\right)\end{matrix}\right.\) => 65a + 56b + 27c = 10,65 (1)
PTHH: Zn + 2HCl --> ZnCl2 + H2
Fe + 2HCl --> FeCl2 + H2
2Al + 6HCl --> 2AlCl3 + 3H2
=> \(n_{H_2}=a+b+1,5c=\dfrac{5,04}{22,4}=0,225\left(mol\right)\) (2)
PTHH: Zn + Cl2 --to--> ZnCl2
2Fe + 3Cl2 --to--> 2FeCl3
2Al + 3Cl2 --to--> 2AlCl3
=> \(n_{Cl_2}=a+1,5b+1,5c=\dfrac{5,6}{22,4}=0,25\left(mol\right)\) (3)
(1)(2)(3) => \(\left\{{}\begin{matrix}a=0,1\left(mol\right)\\b=0,05\left(mol\right)\\c=0,05\left(mol\right)\end{matrix}\right.\) => \(\left\{{}\begin{matrix}m_{Zn}=0,1.65=6,5\left(g\right)\\m_{Fe}=0,05.56=2,8\left(g\right)\\m_{Al}=0,05.27=1,35\left(g\right)\end{matrix}\right.\)
a) \(\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{6,5}{10,65}.100\%=61,033\%\\\%m_{Fe}=\dfrac{2,8}{10,65}.100\%=26,291\%\\\%m_{Al}=\dfrac{1,35}{10,65}.100\%=12,676\%\end{matrix}\right.\)
b) nHCl = 2a + 2b + 3c = 0,45 (mol)
=> mHCl = 0,45.36,5 = 16,425 (g)
=> \(a\%=C\%=\dfrac{16,425}{200}.100\%=8,2125\%\)
c) mdd sau pư = 10,65 + 200 - 0,225.2 = 210,2 (g)
=> \(\left\{{}\begin{matrix}C\%_{ZnCl_2}=\dfrac{0,1.136}{210,2}.100\%=6,47\%\\C\%_{FeCl_2}=\dfrac{0,05.127}{210,2}.100\%=3,02\%\\C\%_{AlCl_3}=\dfrac{0,05.133,5}{210,2}.100\%=3,176\%\end{matrix}\right.\)

Gọi số mol của Cu, Fe, Al trong 23,8 gam hhX lần lượt là x, y, z mol
→ mX = 64x + 56y + 27z = 23,8 (1)
\(n_{Cl_2}\) = x + 1,5y + 1,5z = 0,65 (2)
0,25 mol X + HCl → 0,2 mol H2 nên 0,2.(x + y + z) = 0,25.(y + 1,5z) (3)
Từ (1), (2), (3) => x = 0,2 mol; y = 0,1 mol; z = 0,2 mol
\(\%_{Cu} = \dfrac{0,2. 64}{23,8} \approx 53,78\%\)
\(\%_{Fe} = \dfrac{0,1 .56}{23,8} \approx 23,53\%\)
%Al ≈ 22,69%

Đáp án : A
Trong 53,75g X có x mol Sn ; y mol Fe ; z mol Al
=> t(119x + 56y + 27z) = 53,75g
X + Cl2 -> SnCl4 ; FeCl3 ; AlCl3
⇒ t 4 x + 3 y + 3 z = 2 n C l 2 = 2 , 25 m o l
(Trong 0,4 mol lượng chất gấp t lần)
=> 9(119x + 56y + 27z) = 215(4x + 3y + 3z)
=> 211x – 141y – 402z = 0(1)
=> x + y + z = 0,4 mol(2)
n H 2 = x + y + 1,5z = 31/70 (mol) (3)
Từ (1,2,3) => z = 0,0857 mol
=> mAl = 2,314g
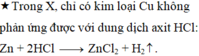



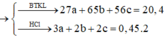
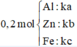
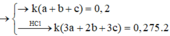
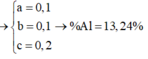

Gọi x,y,z lần lượt là số mol của Zn, Fe, Cu trong hh đầu
.......k là tỉ lệ của hh X sau so với hh đầu
nH2 = \(\dfrac{2,24}{22,4}=0,1\) mol
Pt: Zn + 2HCl --> ZnCl2 + H2
.......x....................................x
......Fe + 2HCl --> FeCl2 + H2
.......y....................................y
Ta có: 65x + 56y + 64z = 9,25 (1)
...........x + y = 0,1 (2)
nCl2 = \(\dfrac{7,84}{22,4}=0,35\) mol
Pt: Zn + Cl2 --to--> ZnCl2
......kx......kx
.....2Fe + 3Cl2 --to--> 2FeCl3
......ky.....1,5ky
......Cu + Cl2 --to--> CuCl2
........kz.....kz
Ta có: (x + y + z).k = 0,3
...........(x + 1,5y + z).k = 0,35
\(\Rightarrow\dfrac{\left(x+1,5y+z\right).k}{\left(x+y+z\right).k}=\dfrac{0,35}{0,3}\)
\(\Leftrightarrow\dfrac{x+1,5y+z}{x+y+z}=\dfrac{7}{6}\)
=> x - 2y + z = 0 (3)
Từ (1), (2) và (3) ta có hệ: \(\left\{{}\begin{matrix}65x+56y+64z=9,25\\x+y=0,1\\x-2y+z=0\end{matrix}\right.\) \(\Leftrightarrow x=y=z=0,05\)
mZn = 0,05 . 65 = 3,25 (g)
mFe = 0,05 . 56 = 2,8 (g)
mCu = 0,05 . 64 = 3,2 (g)