Tính số mol, số phân tử của các chất sau: a) 16 gam SO3 b) 8 gam NaOH c) 16 gam Fe2(SO4)3 d) 34,2 gam Al2(SO4)3
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Bài 1 :
Số mol , khối lượng , số phân tử của các chất lần lượt là :
\(a.\)\(\)
\(n_{O_2}=\dfrac{1.12}{22.4}=0.05\left(mol\right)\)
\(m_{O_2}=0.05\cdot32=1.6\left(g\right)\)
\(0.05\cdot6\cdot10^{23}=0.3\cdot10^{23}\left(pt\right)\)
\(b.\)
\(n_{SO_3}=\dfrac{2.24}{22.4}=0.1\left(mol\right)\)
\(m_{SO_3}=0.1\cdot80=8\left(g\right)\)
\(0.1\cdot6\cdot10^{23}=0.6\cdot10^{23}\left(pt\right)\)
\(c.\)
\(n_{H_2S}=\dfrac{36}{22.4}=\dfrac{45}{28}\left(mol\right)\)
\(m_{H_2S}=\dfrac{45}{28}\cdot34=\dfrac{765}{14}\left(g\right)\)
\(\dfrac{45}{28}\cdot6\cdot10^{23}=\dfrac{135}{14}\cdot10^{23}\left(pt\right)\)
\(d.\)
\(n_{C_4H_{10}}=\dfrac{4.48}{22.4}=0.2\left(mol\right)\)
\(m_{C_4H_{10}}=0.2\cdot58=11.6\left(g\right)\)
\(0.2\cdot6\cdot10^{23}=1.2\cdot10^{23}\left(pt\right)\)
Bài 2 :
\(a.\)
\(n_{SO_3}=\dfrac{16}{80}=0.2\left(mol\right)\)
Số phân tử SO3 : \(0.2\cdot6\cdot10^{23}=1.2\cdot10^{23}\left(pt\right)\)
\(b.\)
\(n_{NaOH}=\dfrac{8}{40}=0.2\left(mol\right)\)
Số phân tử NaOH : \(0.2\cdot6\cdot10^{23}=1.2\cdot10^{23}\left(pt\right)\)
\(c.\)
\(n_{Fe_2\left(SO_4\right)_3}=\dfrac{16}{400}=0.04\left(mol\right)\)
Số phân tử Fe2(SO4)3 : \(0.04\cdot6\cdot10^{23}=0.24\cdot10^{23}\left(pt\right)\)
\(d.\)
\(n_{Al_2\left(SO_4\right)_3}=\dfrac{34.2}{342}=0.1\left(mol\right)\)
Số phân tử Al2(SO4)3 : \(0.1\cdot6\cdot10^{23}=0.6\cdot10^{23}\left(pt\right)\)

PTHH: \(Fe_2\left(SO_4\right)_3+6NaOH\rightarrow3Na_2SO_4+2Fe\left(OH\right)_3\downarrow\)
\(Al_2\left(SO_4\right)_3+6NaOH\rightarrow3Na_2SO_4+2Al\left(OH\right)_3\downarrow\)
Ta có: \(n_{NaOH\left(p/ứ\right)}=6n_{Fe_2\left(SO_4\right)_3}+6n_{Al_2\left(SO_4\right)_3}=6\cdot\left(\dfrac{8}{400}+\dfrac{13,68}{342}\right)=0,36\left(mol\right)\)
Mà \(\Sigma n_{NaOH}=\dfrac{16,8}{40}=0,42\left(mol\right)\) \(\Rightarrow n_{NaOH\left(dư\right)}=0,06\left(mol\right)\)
PTHH: \(NaOH+Al\left(OH\right)_3\rightarrow NaAlO_2+2H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{Al\left(OH\right)_3}=2n_{Al_2\left(SO_4\right)_3}=0,08\left(mol\right)\\n_{NaOH\left(dư\right)}=0,06\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\) NaOH p/ứ hết
\(\Rightarrow\left\{{}\begin{matrix}n_{Na_2SO_4}=0,04\cdot3+0,02\cdot3=0,18\left(mol\right)\\n_{NaAlO_2}=0,06\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}C_{M_{Na_2SO_4}}=\dfrac{0,18}{0,5}=0,36\left(M\right)\\C_{M_{NaAlO_2}}=\dfrac{0,06}{0,5}=0,12\left(M\right)\end{matrix}\right.\)

\(n_{CO2}=\frac{8,8}{44}=0,2\left(mol\right)\)
\(n_{CuSO4}=\frac{16}{160}=0,1\left(mol\right)\)
\(n_{Fe2\left(SO4\right)3}=\frac{3,2}{400}=0,008\left(mol\right)\)

Đáp án D
• 0,42 mol NaOH + 0,02 mol Fe2(SO4)3; 0,04 mol Al2(SO4)3 → 500ml X + ↓
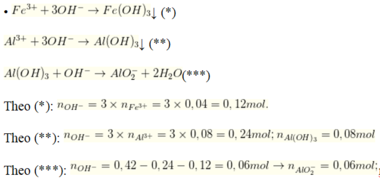
nAl(OH)3 = 0,08 - 0,06 = 0,02 mol
Vậy sau phản ứng 500ml dung dịch X gồm 0,06 mol Na[Al(OH)4]; 0,18 mol Na2SO4
→ CM các chất trong X là CMNa2SO4 = 0,06 : 0,5 = 0,12 M;
CMNa[Al(OH)4] = 0,18 : 0,5 = 0,36 M

\(a,n_{\left(NH_4\right)_3PO_4}=0,6\left(mol\right)\\ \Rightarrow n_N=0,6.3=1,8\left(mol\right)\Rightarrow m_N=1,8.14=25,2\left(g\right)\\ n_H=4.3.0,6=7,2\left(mol\right)\Rightarrow m_H=7,2.1=7,2\left(g\right)\\ n_P=n_{hc}=0,6\left(mol\right)\Rightarrow m_P=0,6.31=18,6\left(g\right)\\ n_O=4.0,6=2,4\left(mol\right)\Rightarrow m_O=2,4.16=38,4\left(g\right)\)
\(b,n_S=\dfrac{6,4}{32}=0,2\left(mol\right)\Rightarrow n_{Al_2\left(SO_4\right)_3}=\dfrac{1}{3}.0,2=\dfrac{1}{15}\left(mol\right)\\ \Rightarrow m_{Al_2\left(SO_4\right)_3}=342.\dfrac{1}{15}=22,8\left(g\right)\\ c,n_{Al_2\left(SO_4\right)_3}=\dfrac{20,52}{342}=0,06\left(mol\right)\\ n_O=4.3.0,06=0,72\left(mol\right)\\ \Rightarrow n_{CO_2}=\dfrac{0,72}{2}=0,36\left(mol\right)\Rightarrow V_{CO_2\left(đktc\right)}=0,36.22,4=8,064\left(l\right)\)

Ta có : \(n_{O2}=\dfrac{V}{22,4}=0,05\left(mol\right)\)
\(\Rightarrow O2=n.A=3.10^{22}\) ( phân tử )
Ta có : \(n_{SO3}=\dfrac{V}{22,4}=0,1\left(mol\right)\)
\(\Rightarrow SO3=n.A=6.10^{22}\) ( phân tử )
Ta có : \(n_{NaOH}=\dfrac{m}{M}=0,4\left(mol\right)\)
\(\Rightarrow NaOH=n.A=2,4.10^{23}\) ( phân tử )
Ta có : \(n_{SO3}=\dfrac{m}{M}=0,405\left(mol\right)\)
\(\Rightarrow SO3=n.A=2,4381.10^{23}\) ( phân tử )

a)
$n_{Al_2(SO_4)_3} = \dfrac{75,24}{27.2 + 32.3 + 16.12} = 0,22(mol)$
b)
$n_{O_2} = \dfrac{15,68}{22,4} = 0,7(mol)$
c)
$n_{H_2SO_4} = \dfrac{13,2.10^{23}}{6.10^{23}} = 2,2(mol)$
d)
$n_{Fe} = \dfrac{11,2}{56} = 0,2(mol)$
$n_{Al} = \dfrac{3,24}{27} = 0,12(mol)$
$n_{X} = 0,2 + 0,12 = 0,32(mol)$
e)
$n_{O_2} = \dfrac{8,94}{22,4} = 0,4(mol)$
$n_{H_2} = \dfrac{2,24}{22,4} = 0,1(mol)$
$n_Y = 0,4 + 0,1 = 0,5(mol)$
a) nAl2(SO4)3= mAl2(SO4)3/M(Al2(SO4)3)= 75,24/342=0,22(mol)
b) nO2=V(O2,đktc)/22,4=15,68/22,4=0,7(mol)
c) nH2SO4=N/6.1023= (13,2.1023)/(6.1023)= 2,2(mol)
d) nX có:
Số mol Fe: nFe= mFe/M(Fe)=11,2/56=0,2(mol)
Số mol Al: nAl=mAl/M(Al)=3,24/27=0,12(mol)
e) nY có:
Số mol O2: nO2=V(O2,đktc)/22,4=8,94/22,4=447/1120(mol)
Số mol H2: nH2=V(H2,đktc)/22,4=2,24/22,4=0,1(mol

Câu a.
\(M_{Ca\left(NO_3\right)_2}=164\)g/mol
\(m_{Ca\left(NO_3\right)_2}=0,3\cdot164=49,2g\)
\(\%Ca=\dfrac{40}{164}\cdot100\%=24,39\%\)
\(m_{Ca}=\%Ca\cdot49,2=12g\)
\(\%N=\dfrac{14\cdot2}{164}\cdot100\%=17,07\%\)
\(m_N=\%N\cdot49,2=8,4g\)
\(m_O=49,2-12-8,4=28,8g\)
Các câu sau em làm tương tự nhé!
a) \(n_{SO3}=\dfrac{16}{80}=0,2\left(mol\right)\)
⇒ \(A=0,2.6.10^{-23}=1,2.10^{-23}\) (phân tử)
b) \(n_{NaOH}=\dfrac{8}{40}=0,2\left(mol\right)\)
⇒ \(A=0,2.6.10^{-23}=1,2.10^{-23}\) (phân tử)
c) \(n_{Fe2\left(SO4\right)3}=\dfrac{16}{400}=0,04\left(mol\right)\)
⇒ \(A=0,04.6.10^{-23}=0,24.10^{-23}\) (phân tử)
d) \(n_{Al2\left(SO4\right)3}=\dfrac{34,2}{342}=0,1\left(mol\right)\)
⇒ \(A=0,1.6.10^{-23}=0,6.10^{-23}\) (phân tử)
Chúc bạn học tốt