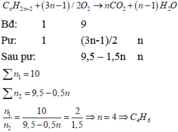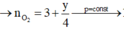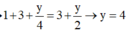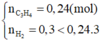người ta trộn một hydrocacbon với oxy ( oxy được lấy gấp đôi lượng cần dùng ) lấy 0.5l (135.5 độ 1atm ) sau đó bật tia lửa điện để ddoodt cháy hết hydrocacbon đưa bình về nhiệt độ ban đầu thì áp suất vẫn là 1 atm nhưng khi đưa bình về 0 độ thì áp suất là 0.52 atm . Xác định công thức phân tử của hydrocacbon
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Thử làm câu 1, câu 2 tương tự:
\(C_xH_y+\left(x+\frac{y}{4}\right)O_2\rightarrow xCO_2+\frac{y}{2}H_2O\)
\(pV=RnT\Rightarrow n_{hh}=\frac{pV}{RT}=\frac{1.0,5}{0,082.\left(273+135,5\right)}\approx0,015\left(mol\right)\)
Do khi hạ nhiệt độ xuống bằng nhiệt độ ban đầu, áp suất hỗn hợp sau khi đốt bằng áp suất ban đầu nên số mol cũng bằng số mol ban đầu hay:
\(1+x+\frac{y}{4}=x+\frac{y}{2}\Rightarrow y=4\)
Gọi số mol \(C_xH_4\) ban đầu là \(a\Rightarrow n_{O_2}=2a\left(x+1\right)\); \(n_{CO2}=a.x\)
Ta có: \(a+2a\left(x+1\right)=0,015\)
Khi hạ nhiệt xuống \(0^0C\) thì phần hơi nước ngưng tụ và đóng băng, áp suất khí trong bình chỉ còn do \(CO_2\) và \(O_2\) dư gây ra
Khí trong bình khi đó còn \(a\left(x+1\right)\) mol \(O_2\) dư và \(ax\) mol \(CO_2\) \(\Rightarrow\) tổng số mol khí là \(2ax+a\)
Áp dụng pt trạng thái khí:
\(pV=RnT\Rightarrow0,52.0,5=0,082.\left(2ax+a\right).273\)
\(\Rightarrow2ax+a=\frac{10}{861}\)
\(\Rightarrow\left\{{}\begin{matrix}2ax+3a=0,015\\2ax+a=\frac{10}{861}\end{matrix}\right.\) \(\Rightarrow x=3\)
Vậy hidrocacbon là \(C_3H_4\)
Ủa sai ở đâu mà ko giống đáp án vậy ta :(

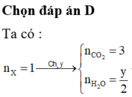
Chọn đáp án B
đốt E dạng C n H 2 n O 2 + 3 n - 2 2 O 2 → t o n C O 2 + n H 2 O
chọn n E = 1 m o l
⇒ n O 2 t r o n g b ì n h = 2 n O 2 c ầ n = 3 n - 2 m o l
điều kiện cùng T và V ⇒ n s a u : n t r ư ớ c = p s a u : p t r ư ớ c = 0 , 95 : 0 , 8
⇒ n s a u = 1 , 1875 × 3 n - 1 m o l = ∑ n C O 2 + n H 2 O + n O 2 c ò n d ư
⇄ 2n + (3n – 2) ÷ 2 = 1,1875 × (3n – 1)
⇒ n = 3 → CTPT của E là C 3 H 6 O 2 .