Dung dịch X chứa 200ml hh NAOH 0,1M, KOH 0,1M và BA(OH)2 0,1M. Tính thể tích dung dịch H2SO4 0,1M để trung hòa hết dd 50ml dd X?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


n H + = n OH - → 0,5.2.V = 0,1.(0,1 + 0,2.2) → V = 0,05 lít
Đáp án A

nOH- = (0,2 + 0,1.2)V = 0,4V; nH+ = (0,25.2 + 0,75).0,04 = 0,05
Do trung hòa nên nOH- = nH+ → 0,4V = 0,05 → V = 0,125 lít
Đáp án B

a)
Gọi thể tích hai bazo là V
Suy ra :
n NaOH = 0,1V ; n Ba(OH)2 = 0,15V
n HCl = 0,2.0,2 = 0,04(mol) ; n H2SO4 = 0,2.0,1 = 0,02(mol)
Bản chất của phản ứng là H trong axit tác dụng với OH trong bazo tạo thành nước :
$H + OH \to H_2O$
n H = n HCl + 2n H2SO4 = 0,08(mol)
n OH = n NaOH + 2n Ba(OH)2 = 0,4V
Theo PTHH :
n H = n OH <=> 0,08 = 0,4V <=> V = 0,2(lít)
b) Dung dịch sau pư có :
Na+ : 0,02
Ba2+ :
Cl- : 0,04
Bảo toàn điện tích => n Ba2+ = 0,01(mol)
=> n BaSO4 = n Ba(OH)2 - n Ba2+ = 0,03 - 0,01 = 0,02
m BaSO4 = 0,02.233 = 4,66 gam
vì sao lại có đoạn này vậy ạ :
n H = n HCl + 2n H2SO4 = 0,08(mol)

Chọn đáp án D
Cần thật thật chú ý là trộn 3 thể tích bằng nhau các dung dịch
⇒ tạo 300 ml dung dịch X gồm 100 mL HCl 0,3M; 100 mL H2SO4 0,2M và 100 mL H3PO4 0,1M ||⇒
![]() mol.
mol.
V mL dung dịch Y gồm 2x mol NaOH và x mol Ba(OH)2
⇒ ![]() x mol.
x mol.
Phản ứng trung hòa:
![]()
⇒ 4x = 0,1 ⇒ x = 0,025 mol ⇒ V = n ÷ CM = 0,025 ÷ 0,1 = 0,25 lít ⇔ 250 mL.
⇒ chọn đáp án D.

Đáp án D
VX = 0,3 lit
=> Thể tích mỗi dung dịch axit thành phần là 0,1 lit
=> nH+ = nHCl + 2nH2SO4 + 3nH3PO4 = 0,1.0,3 + 2.0,1.0,2 + 3.0,1.0,1 = 0,1 mol
Để trung hòa thì : nH+ = nOH- = 0,1 mol
Có : nOH- = nNaOH + 2nBa(OH)2 = (0,2 + 0,1.2).V.10-3 = 0,1 mol
=> V = 250 ml
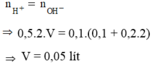
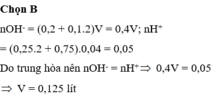

Nồng độ các chất trong 50mL dd X:
NaOH: 0.005 Mol
KOH: 0.005 Mol
Ba(OH)2: 0.01 Mol
Phản ứng của H2SO4 với Ba(OH)2:
H2SO4 + Ba(OH)2 -> BaSO4 + 2H2O
Số mol H2SO4 cần: 0.01 Mol
H+ + OH- -> H2O
Số mol H+ cần: 0.01 Mol => mol H2SO4 cần 0.005 mol.
Lượng mol H2SO4 tổng: 0.015 mol.
=> V H2SO4 = 0.015/0.1 = 0.15 L = 150 mL H2SO4 0.1M