Cho hỗn hợp A gồm MgO, Al2O3 và R2O3 . Lấy 15,4g A cho vào ống sứ nung nóng rồi cho luồng khí
H2 dư đi qua thu được hỗn hợp B (H2 và hơi nước ) và chất rắn D. Lượng hơi nước trong B hấp thụ hết bằng 15,3 g dung dich H2SO4 90% thu được dung dịch H2SO4 84,07%. Đem rắn D hòa tan trong dung dịch NaOH dư, thì có 4,8 g NaOH phản ứng và còn lại chất rắn không tan E. Cho E vào dung dịch Cu(NO3)2 dư thì thu được 8,64g rắn F .
Cho các phản ứng xảy ra hoàn toàn ( R không phản ứng dung dịch NaOH ) .
a) Xác định R2O3 . Tính % các chất trong A .
help me . Bạn nào làm nhanh đúng, giải cụ thể mình tick !!!!
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(m_{H_2SO_4}=\dfrac{100.96,48}{100}=96,48\left(g\right)\)
\(m_{dd.sau.thí.nghiệm}=\dfrac{96,48.100}{90}=107,2\left(g\right)\)
=> \(m_{H_2O\left(thêm\right)}=107,2-100=7,2\left(g\right)\Rightarrow n_{H_2O}=\dfrac{7,2}{18}=0,4\left(mol\right)\)
=> nO(mất đi) = 0,4 (mol)
Có: mX = mY + mO(mất đi) = 113,6 + 0,4.16 = 120 (g)

a./ Khối lượng H2SO4: m(H2SO4) = 15,3.90% = 13,77g
Khối lượng dd axit sau khi hấp thụ H2O: m(dd sau) = 13,77/86,34% gam
Khối lượng H2O bị hấp thụ: m(H2O ht) = m(dd sau) - m(dd đầu) = 13,77/86,34% - 15,3
Khối lượng H2O tạo ra từ phản ứng khử MO:
m(H2O) = m(H2O ht)/90% = [13,77/86,34% - 15,3]/90% = 0,72g
→ n(H2O) = 0,72/18 = 0,04mol
H2 + MO → M + H2O
___________0,04__0,04
M = 2,56/0,04 = 64
→ kim loại M cần tìm là Cu
b./ Gọi x, y là số mol của MgO và Al2O3 có trong hh A
Số mol CuO có trong hh A: n(CuO) = 0,04/80% = 0,05mol
m(hh A) = m(MgO) + m(Al2O3) + m(CuO) = 40x + 102y + 0,05.80 = 16,2g
Số mol CuO có trong hh chất rắn sau pư với H2: n(CuO sau) = 0,05-0,04 = 0,01mol
Cho hh chất rắn tác dụng với HCl
MgO + 2HCl → MgCl2 + 2H2O
x______________x
Al2O3 + 6HCl → 2AlCl3 + 3H2O
y_______________2y
CuO + 2HCl → CuCl2 + 2H2O
0,01__________0,01
Lấy 1/20 dung dịch B tác dụng với NaOH dư
AlCl3 + 4NaOH → NaAlO2 + 3NaCl + 2H2O
MgCl2 + 2NaOH → Mg(OH)2 + 2NaCl
x/10______________x/10
CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl
0,001_____________0,001
Nung kết tủa đến khối lượng không đổi
Mg(OH)2 → MgO + H2O
x/10_______x/10
Cu(OH)2 → CuO + H2O
0,001_____0,001
m(oxit) = m(MgO) + m(CuO) = 40.x/10 + 0,001.80 = 0,28g
→ x = 0,05mol → y = (16,2 - 0,05.40 - 0,05.80)/102 = 0,1mol
Khối lượng mỗi oxit trong A
m(MgO) = 0,05.40 = 2g; m(Al2O3) = 0,1.102 = 10,2g; m(CuO) = 0,05.80 = 4g
Phần trăm khối lượng mỗi oxit
%MgO = 2/16,2 .100% = 12,36%
%Al2O3 = 10,2/16,2 .100% = 62,96%
%CuO = 4/16,2 .100% = 24,68%
Câu b của bạn Hậu Duệ Mặt Trời chép mạng và nó sai hoàn toàn.

Ta có thể tổng quát các phản ứng như sau:
![]()
Quan sát 2 phản ứng trên, ta nhận thấy: khối lượng hỗn hợp khí và hơi thu được sau phản ứng nặng hơn hỗn hợp CO, H2 ban đầu là do H2, CO đã "chiếm lấy" những nguyên tử O trong oxit.
Khi đó khối lượng hỗn hợp khí tăng lên chính là khối lượng mà chất rắn đã giảm đi sau phản ứng hay khối lượng này chính là khối lượng của những nguyên tử oxi trong oxit bị "chiếm mất".
Suy ra m c h ấ t r ắ n p h ả n ứ n g - m o x i b a n đ ầ u - 0 , 32 = 16 , 48 ( g a m )
Cũng quan sát các phản ứng hoặc sử dụng định luật BTNT đối với C, H, có:
![]()
Đáp án B.

Đáp án B
Định hướng tư duy giải:
Chất rắn X gồm: Al2O3, Cu, MgO, Fe vì vậy khi hòa tan vào dung dịch HCl loãng dư chỉ thu được 3 muối là MgCl2, AlCl3, FeCl2 (phản ứng không tạo Fe3+ nên không thể hòa tan Cu).

Đáp án B
Định hướng tư duy giải:
Chất rắn X gồm: Al2O3, Cu, MgO, Fe vì vậy khi hòa tan vào dung dịch HCl loãng dư chỉ thu được 3 muối là MgCl2, AlCl3, FeCl2 (phản ứng không tạo Fe3+ nên không thể hòa tan Cu).

Đáp án B
Định hướng tư duy giải:
Chất rắn X gồm: Al2O3, Cu, MgO, Fe vì vậy khi hòa tan vào dung dịch HCl loãng dư chỉ thu được 3 muối là MgCl2, AlCl3, FeCl2 (phản ứng không tạo Fe3+ nên không thể hòa tan Cu).

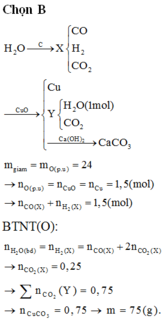
Gọi M và MO là kim loại và oxit của nó.
Khi nung hỗn hợp A ta có: MO + H2 → M + H2O (1)
MgO và Al2O3 không phản ứng.
Hoà tan chất rắn trong HCl xảy ra các phản ứng:
MgO + 2HCl → MgCl2 + H2O (2)
x ............................x
Al2O3 + 6HCl → 2AlCl3 + 3H2O (3)
y .............................2y
Dung dịch B chứa MgCl2 và AlCl3.
Khi tác dụng với NaOH:
AlCl3 + 3NaOH → Al(OH)3 + 3NaCl (4)
MgCl2 + 2NaOH → Mg(OH)2 + 2NaCl (5)
x ................2x............ x
Nếu dư NaOH: Al(OH)3 + NaOH → NaAlO2 + 2H2O (6)
Biện luận: Có thể có xảy ra 3 trường hợp là thiếu, đủ, dư NaOH.
* Thiếu NaOH: 13,9< m(chất rắn sau nung)<16,4 >> 6,08 => Loại
* Đủ NaOH (Al(OH)3 không phản ứng): m(chất rắn sau nung)=12,2 > 6,08 => loại
* NaOH dư: Hai trường hợp
Khi nung kết tủa, ta được:
2Al(OH)3 \(\rightarrow\) Al2O3 + 2H2O (7)
2z................... z
Mg(OH)2 MgO + H2O (8)
* Xác định tên kim loại:
Khối lượng H2SO4 có trong 15,3 g dung dịch H2SO4 90% là 15,3.90/100 = 13,77 gam
Vậy khối lượng nước thoát ra từ (1) là 2,43 – 1,53 = 0,9 gam = 0,05 mol H2O
Chất rắn trong ống còn lại gồm kim loại M, MgO và Al2O3. Chỉ có MgO và Al2O3 tan trong HCl. Do đó, 3,2 gam chất rắn không tan là M. Theo (2) n(M) = n(H2O) => M= 3,2/0,05 = 64. Vậy kim loại cần tìm là Cu.
* Xác định thành phần trăm khối lượng của A:
+ Trường hợp chất rắn sau nung gồm 2 oxit:
Đặt x, y lần lượt là số mol của MgO, Al2O3 có trong 16,5 gam A. z là số mol Al2O3 trong hỗn hợp oxit sau khi nung, ta có: n(CuO) = 0,05. m(CuO)= 0,05.80 = 4 gam.
Vậy 40x + 102y = 16,2-4 = 12,2 (9)
40x+102z = 6,08 (10)
n(NaOH) đã dùng: 0,82.1 = 0,82. Trong đó đã dùng 2x mol theo(2,5) , dùng 6z mol theo (4,7) => số mol NaOH đã dùng ở (6) = 0,82-2x-6z.
Theo (4,6): n(AlCl3)= 1/4. (0,82-2x-6z).
Vậy: (0,82-2x-6z)/4 +z=y (11)
Giải hệ (9,10,11) được: x = 0,05. y=0,1. z=0,04
Do đó khối lượng CuO là 4 gam.
m(MgO)=0,05.40=2gam =>12,35%
m(CuO) = 4 g => 24,69%
m(Al2O3) => 62,96%
+ Trường hợp chất rắn sau nung chỉ 1 oxit MgO:
m(MgO) = 40x = 6,08 (13)
Giải hệ (12,13) được: x = 0,152. y=0,06.
n(NaOH) đã dùng 2x mol theo(2,5) , dùng 8y mol theo (3,4,7):
n(NaOH)= 2.0,152 + 8. 0,06 = 0,784 < 0,82 thoả mãn
Do đó khối lượng CuO là 4 gam.
m(MgO)=0,152.40=6.08 gam =>37,53%
m(CuO) = 4 g => 24,69%
m(Al2O3) => 37,78%
Em có làm nhầm đề ko? Trong đề đâu có nói là cho hỗn hợp chất rắn D tác dụng với HCl???