Cho mạt sắt vào một dung dịch chứa 0,2 mol H2SO4 loãng. Sau một thời gian, bột sắt tan hoàn toàn và người ta thu được 1,68 lít khí hiđro (đktc).
a) Khối lượng mạt sắt đã phản ứng.
b) Để có lượng sắt tham gia phản ứng trên, phải cho bao nhiêu gam sắt(III) oxit tác dụng với khí hiđro?

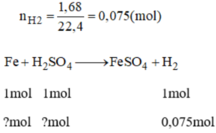
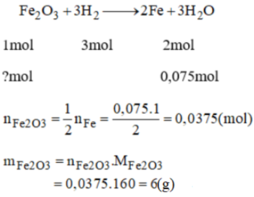

nH2=\(\dfrac{1,68}{22,4}\)=0,075mol
Fe + H2SO4 -> FESO4 + H2
n ban đầu: 0,2mol
n pứ: 0,075mol 0,075mol 0,075mol
Vì \(\dfrac{0,2}{1}\)>\(\dfrac{0,075}{1}\) nên H2SO4 dư
a) mFe pứ= 0,075.56=4,2g
b) Fe2O3 + 3H2 -> 2Fe + 3H2O
n pứ: 0,0375mol 0,075mol
mFe2O3 pứ=0,0375.160=6g